题目内容
10.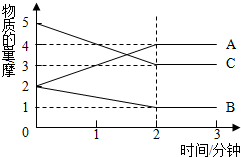 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
分析 从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程.
解答 解:由图象可以看出,B、C的物质的量逐渐减小,则B、C为反应物,A的物质的量逐渐增多,作为A为生成物,当反应到达2min时,△n(C)=5mol-3mol=2mol,△n(B)=2mol-1mol=1mol,△n(A)=4mol-2mol=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(B):△n(C):△n(A)=1:2:2,所以反应的化学方程式为:2C+B?2A,故答案为:2C+B?2A.
点评 本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 苯和溴苯 | ||
| C. | 乙酸乙酯和Na2CO3溶液 | D. | 苯和四氯化碳 |
1.实验中的下列操作叙述正确的是( )
| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
18.下列叙述不正确的是( )
| A. | CO2的摩尔质量是44 g•mol-1,表示1 mol CO2的质量为44 g | |
| B. | 硫酸溶液的物质的量浓度为1 mol•L-1,表示1 L溶液中含有1 mol硫酸 | |
| C. | 气体摩尔体积Vm≈22.4 L•mol-1,表示1 mol任何气体的体积都约为22.4 L | |
| D. | 阿伏加德罗常数NA≈6.02×1023 mol-1,表示1 mol任何粒子集体所含的粒子数约为6.02×1023 |
5.标况下,0.1mol某烃在足量氧气中完全燃烧生成4.48LCO2和3.6g水,则该烃可能是( )
| A. | C2H4 | B. | CH4 | C. | C2H2 | D. | C2H6 |
2.下列说法正确的是( )
| A. | 1molCH4 分子中含 10NA个电子 | B. | 22.4LCH4 分子中含 4NA 个共价键 | ||
| C. | 乙烯不能使溴水褪色 | D. | 苯属于烯烃 |
19.把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )
| A. | 1.0mol/L | B. | 2.0mol/L | C. | 3.0mol/L | D. | 4.0mol/L |
20.在盛有硫酸铜饱和溶液的恒温密闭容器中,投入一块形状不规则的硫酸铜晶体,放置数天后,发生的变化是( )
| A. | 晶体形状改变且质量减少 | |
| B. | 晶体形状改变而质量不变 | |
| C. | 晶体形状和质量都不变 | |
| D. | 硫酸铜溶液的物质的量浓度有所增大 |
 无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.
无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.