题目内容
17. 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=kJ•mol-1(用含a、b的代数式表示)0.5a+b;
(2)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图1所示:请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300mlNaCl溶液(过量),阳极的电极反应式为2Cl--2e-=Cl2↑,电解反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-,消耗27mg Al后溶液的pH=12(不考虑溶液体积的变化).
(3)硫酸的年产量可以用来衡量一个国家的无机化工水平.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图2所示(曲线上任何一点都表示平衡状态).下列说法正确的是de
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.若在恒温、恒容条件下向上述平衡体系中通入SO3(g),压强增大,平衡向右移动
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
e.在D点时,v正>v逆.
分析 (1)依据热化学方程式和盖斯定律计算得到对应反应的焓变;
(2)由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=Ag+2OH-,电解NaCl溶液时,阳极氯离子失电子生成氯气,根据电子守恒计算.
(3)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
b、增大生成物的浓度,平衡逆向移动;
c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,据此判断;
d、在A点为平衡点,正逆反应速率相等进行判断.
e、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡.
解答 解:(1)①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g);△H=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ•mol-1
依据盖斯定律①×3+②×6得到:6Al2O3(s)+18C(s)=12Al(l)+18CO(g)△H=(3a+6b)KJ/mol,即Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(0.5a+b)KJ/mol,
故答案为:0.5a+b;
(2)由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,电解NaCl溶液时,阳极氯离子失电子生成氯气,则阳极的电极反应式为2Cl--2e-=Cl2↑;电解反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-;消耗27mg Al,则铝的物质的量为$\frac{m}{M}$=$\frac{27×1{0}^{-3}g}{27g/mol}$=0.001mol,则转移电子为0.003mol,
由电解方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-可知,转移2mol电子生成2molOH-,则转移0.003mol电子时,溶液中生成0.003molOH-,
所以c(OH-)=$\frac{0.003mol}{0.3L}$=0.01mol/L,则溶液的pH=12;
故答案为:Ag2O+2e-+H2O=2Ag+2OH-;2Cl--2e-=Cl2↑;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$C12↑+H2↑+2OH-;12;
(3)a、恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动,故错误;
b、增大生成物的浓度,平衡逆向移动,若在恒温、恒容条件下向上述平衡体系中通入SO3(g),生成物的浓度增大,平衡向左移动,故b错误;
c、由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,K值减小,故平衡常数K1>K2,故错误;
d、在A点为平衡点,正逆反应速率相等,所以消耗1mol SO2必定同时消耗1mol SO3,故正确;
e、D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行建立平衡,所以V正>V逆,故正确;
故选:de.
点评 本题考查了盖斯定律的应用、电解原理的应用和电子守恒在计算中的应用、化学平衡移动、平衡常数的影响因素等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案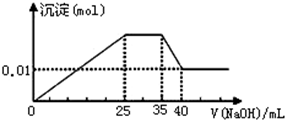 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Fe3+、CO32- | |
| B. | 不能确定原溶液是否含有Na+、Cl- | |
| C. | 实验所加的NaOH的浓度为2mol•L-1 | |
| D. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
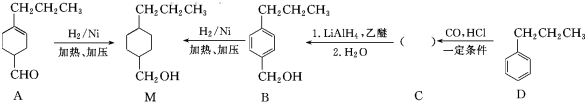
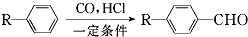
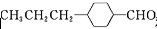 和
和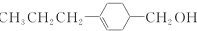 (写结构简式)生成.
(写结构简式)生成.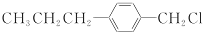 .
.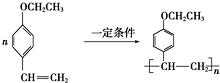 .
.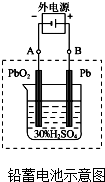 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O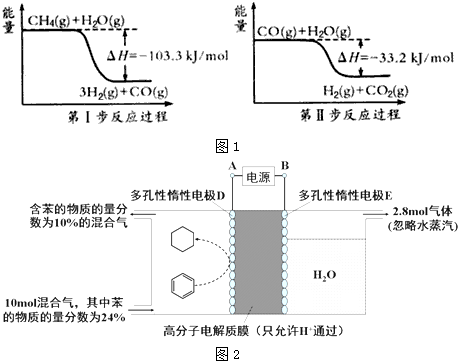
 $?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ +3H2(g)
+3H2(g) (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題: