题目内容
9.在Na2CO3溶液中,有关离子浓度的关系正确的是( )| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
分析 A.Na2CO3为强碱弱酸盐,碳酸根离子水解,c(Na+)>2c(CO32-);
B.Na2CO3为强碱弱酸盐,碳酸根离子水解,溶液呈碱性;
C.Na2CO3为强碱弱酸盐,电离为主,水解程度相对较小;
D.Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,但电离为主,水解生成的氢氧根离子浓度较小.
解答 解:A.Na2CO3为强碱弱酸盐完全电离:Na2CO3 =2Na++CO32-,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,所以c(Na+)>2c(CO32-),故A错误;
B.CO32-水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液中c(H+)<c(OH-)呈碱性,故B错误;
C.Na2CO3为强碱弱酸盐完全电离:Na2CO3 =2Na++CO32-,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,电离为主,水解程度相对较小,所以c(CO32-)>c(HCO3-),故C正确;
D.Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,但电离Na2CO3 =2Na++CO32-为主,CO32-水解程度较小,水解生成的氢氧根离子浓度较小,所以溶液中离子浓度大小顺序是c(CO32-)>c(OH-),故D正确;
故选CD.
点评 本题考查离子浓度大小比较,明确物质的性质和掌握盐类水解的规律是解本题关键,注意可溶性盐的电离大于弱根离子的水解,题目难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
19.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )


| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
17.某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象ⅰ中的红色物质是Cu.
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| 实验操作 | 实验现象 |
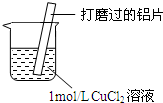 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
4.下列说法正确的是( )
| A. | 反应2CO(g)→2C(s)+O2(g);△H>0不能自发进行,加入适当的催化剂可以自发 | |
| B. | 粗铜电解精炼时,阳极减少的质量与阴极增加的质量一定相同 | |
| C. | 体积均为10mL pH均为2的盐酸与醋酸,分别加入0.1g Zn,最终醋酸产生的H2多 | |
| D. | 一定条件下反应2NO2(g)?N2O4(g)达到平衡时,v(NO2)逆=2v(N2O4)正 |
14.下列有关NH4Al(SO4)2溶液的叙述正确的是( )
| A. | 0.1mol/L的该溶液中含有0.2NA个SO42- | |
| B. | 该溶液中Cu2+、H+、NO3-可以大量共存 | |
| C. | 滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式为:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 该溶液加热蒸干后得到Al2O3固体 |
1.在0.1mol•L-1的NH4HSO4溶液中,下列微粒的物质的量浓度关系不正确的是( )
| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
18.下列说法正确的是( )
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
1.下列有关物质用途的说法错误的是( )
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
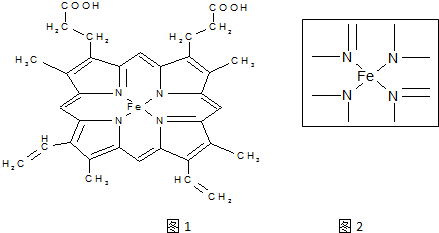
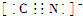 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.