题目内容
4.下列离子方程式错误的是( )| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 氧化亚铁与稀盐酸反应:FeO+3H+═Fe3++H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2 Cl- | |
| D. | 金属钠与水反应:2Na+2H2O═2 Na++2OH-+H2↑ |
分析 A.二者反应生成氯化钠、次氯酸钠和水;
B.稀盐酸和氧化亚铁反应生成氯化亚铁和水;
C.二者反应生成氯化铁;
D.二者反应生成氢氧化钠和氢气.
解答 解:A.二者反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.稀盐酸和氧化亚铁反应生成氯化亚铁和水,离子方程式为FeO+2H+═Fe2++H2O,故B错误;
C.二者反应生成氯化铁,离子方程式为2Fe2++Cl2═2Fe3++2 Cl-,故C正确;
D.二者反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O═2 Na++2OH-+H2↑,故D正确;
故选B.
点评 本题考查离子方程式正误判断,为高频考点,明确物质性质是解本题关键,易错选项是B,如果是硝酸和氧化亚铁混合则生成铁离子和NO,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
10.分析下列合成路线: 则B物质应为下列哪种物质( )
则B物质应为下列哪种物质( )
 则B物质应为下列哪种物质( )
则B物质应为下列哪种物质( )| A. |  | B. |  | C. |  | D. |  |
7.下列化学用语或物质的性质描述正确的是( )
| A. | 右图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 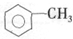 中,所有原子不可能都在同一平面上 中,所有原子不可能都在同一平面上 | |
| D. | 治疗疟疾的青蒿素(如图)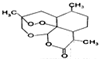 ,分子式是C15H20O5 ,分子式是C15H20O5 |
14.下列有关金属及其合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 纯铁的熔点比生铁的低,抗腐蚀能力比生铁强 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
13.某未知溶液中加入NaOH溶液并加热,有刺激性气味的气体氨气产生,说明溶液中有( )
| A. | Fe3+ | B. | NH4+ | C. | Cl- | D. | SO42- |
14.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 与相同浓度盐酸反应的快慢:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
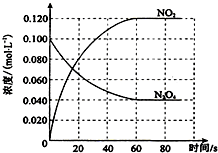 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.