题目内容
2.某小组以石膏(CaSO4•2H2O)为主要原料制备(NH4)2SO4的流程如图: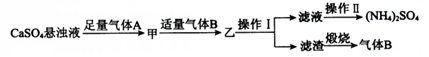
下列说法正确的是( )
| A. | 气体B是NH3,可循环利用 | |
| B. | 操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗 | |
| C. | 操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4 | |
| D. | 整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4 |
分析 由制备流程可知,以石膏(CaSO4•2H2O)为主要原料制备(NH4)2SO4,A、B一定有氨气、二氧化碳,且碱性条件下利用二氧化碳的吸收,滤渣煅烧生成气体B应为CO2,则A为NH3,发生CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,操作I为过滤,分离出沉淀,操作II为蒸发、浓缩、冷却、结晶得到(NH4)2SO4,以此来解答.
解答 解:A.由上述分析可知,气体B是CO2,可循环利用,故A错误;
B.操作Ⅰ为过滤,所用的主要玻璃仪器为烧杯、玻璃棒、漏斗,分液漏斗用于分液,故B错误;
C.(NH4)2SO4受热易分解,则操作Ⅱ为蒸发、浓缩、冷却、结晶,故C错误;
D.由上述分析可知,整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,故D正确;
故选D.
点评 本题考查混合物分离提纯综合应用,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.

练习册系列答案
相关题目
12.下列微粒不能破坏水的电离平衡的是( )
| A. | Fˉ | B. | Fe2+ | C. | Na+ | D. | S2- |
13.相对分子质量都为88的饱和一元醇与饱和一元羧酸发生酯化反应,最多可得到的酯有(不考虑立体异构)( )
| A. | 18种 | B. | 16种 | C. | 14种 | D. | 12种 |
10.化学在生产、生活中有广泛应用,下列对应关系正确的是( )
| 选项 | 化学性质 | 实际应用 |
| A | 碳元素的非金属性比硅强 | 石英和碳粉的混合物高温下反应制备粗硅 |
| B | 乙醇能使蛋白质变性 | 无水乙醇作医用消毒机 |
| C | 明矾溶液显酸性 | 明矾作净水剂 |
| D | 油脂在碱性条件下水解 | 热的NaOH溶液鉴别植物油和矿物质 |
| A. | A | B. | B | C. | C | D. | D |
17.下列实验操作和现象所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液 | NaNO3溶液为无色,Na2SiO3溶液变成红色 | 非金属性:N>Si |
| B | 将湿润的KI-淀粉试纸置于集满某气体的集气瓶口 | 试纸变蓝 | 该气体为Cl2 |
| C | 将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体 | CuSO4颜色未发生改变 | 收集到纯净的SO2 |
| D | 向含有少量FeCl3的FeCl2溶液中加入铜粉 | 铜粉有剩余 | 所得溶液中的溶质只有FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
7.分子式为C6H12O2且能与小苏打溶液反应放出气体的有机物共有几种(不考虑立体异构)( )
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
13.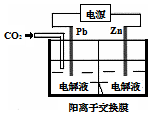 采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
 采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Pb与电源的正极相连 | |
| B. | ZnC2O4在离子交换膜右侧生成 | |
| C. | 正极反应式为:Zn-2e-═Zn2+ | |
| D. | 标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子 |
8.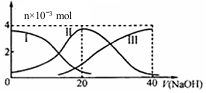 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )| A. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HA-)=c(A2-)+2c(OH-) | |
| D. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
9.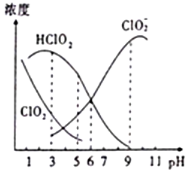 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )
 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )| A. | 25℃时,ClO2-的水解平衡常数Ka=10-6 | |
| B. | 在pH约为4.0~4.5范围内使用该漂白剂较好 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+c(H+)+c(Na+)═c(ClO2-)+2c(OH-) | |
| D. | 当pH=5时往NaClO2溶液中滴入稀氢氧化钠溶液,溶液中主要反应的离子方程式是:HClO2+OH-═H2O+ClO2- |