题目内容
12.下列微粒不能破坏水的电离平衡的是( )| A. | Fˉ | B. | Fe2+ | C. | Na+ | D. | S2- |
分析 水能够电离出氢离子和氢氧根离子,加入的粒子能够影响水电离的氢离子或者氢氧根离子浓度,则会破坏水的电离平衡,如加入含有弱酸根离子或者弱碱根离子的盐、加入酸碱溶液等都能够影响水的电离,以此解答该题.
解答 解:A.Fˉ可水解生成HF,促进水的电离,故A不选;
B.Fe2+可水解生成Fe(OH)2,促进水的电离,故B不选;
C.钠离子不水解,不影响水的电离平衡,故C选;
D.S2-可水解生成HS-,促进水的电离,故D不选.
故选C.
点评 本题考查了水的电离及其影响因素,为高频考点,侧重考查学生的分析能力,题目难度不大,注意掌握水的电离及其影响因素,明确酸碱溶液、含有弱酸根或者弱碱根离子的盐溶液对水的电离平衡的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知氧化性:Br2>Fe3+>I2,向含溶质a mol FeI2的溶液中加入含b mol Br2的溴水,充分反应.下列说法不正解的是( )
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=I2+4Br-+2Fe3+ |
17.下列说法正确的是( )
| A. | s电子云是在空间各个方向上延展程度相同的对称形状 | |
| B. | p电子云是“8”字形的 | |
| C. | 2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5 | |
| D. | 2d能级包含5个原子轨道,最多容纳10个电子 |
4. 向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )
向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )
 向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )
向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法,错误的是( )| A. | 溶液pH:b>c>a | |
| B. | a点:c(H+)-c(OH-)=$\frac{1}{2}$[c(CH3COO-)-c(CH3COOH)] | |
| C. | a到b,溶液中可能存在:c(CH3COO-)=c(Na+) | |
| D. | b到c,溶液中可能存在:c(CH3COO-)=c(OH-) |
1.向一定量的FeO、Fe、Fe2O3的混合物中加入100mL 1mol/L盐酸,恰好使混合物完全溶解,放出112mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
2.某小组以石膏(CaSO4•2H2O)为主要原料制备(NH4)2SO4的流程如图: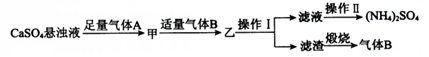
下列说法正确的是( )
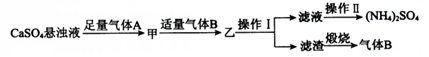
下列说法正确的是( )
| A. | 气体B是NH3,可循环利用 | |
| B. | 操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗 | |
| C. | 操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4 | |
| D. | 整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4 |
 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1