题目内容
有下列四组物质,如果把某组物质中的后者逐滴加人到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是( )
| A、稀硫酸、氯化钡溶液 |
| B、硫酸亚铁溶液、氢氧化钠溶液 |
| C、氯化钠溶液、硝酸银溶液 |
| D、氯化铝溶液、氢氧化钠溶液 |
考点:两性氧化物和两性氢氧化物
专题:
分析:A.生成硫酸钡沉淀;
B.先生成氢氧化亚铁白色沉淀,迅速变为灰绿色,最终变为红褐色沉淀;
C.生成氯化银沉淀;
D.将氢氧化钠溶液中滴入氯化铝溶液,开始生成氢氧化铝白色沉淀,继续滴加氢氧化钠,氢氧化铝与氢氧化铝反应生成偏铝酸钠.
B.先生成氢氧化亚铁白色沉淀,迅速变为灰绿色,最终变为红褐色沉淀;
C.生成氯化银沉淀;
D.将氢氧化钠溶液中滴入氯化铝溶液,开始生成氢氧化铝白色沉淀,继续滴加氢氧化钠,氢氧化铝与氢氧化铝反应生成偏铝酸钠.
解答:
解:A.稀硫酸与氯化钡溶液反应生成硫酸钡白色沉淀,故A不符合;
B.先生成氢氧化亚铁白色沉淀,氢氧化亚铁被氧化,迅速变为灰绿色,最终变为红褐色沉淀,故B不符合;
C.氯化钠溶液与硝酸银溶液反应生成氯化银白色沉淀,故C不符合;
D.将氢氧化钠溶液中滴入氯化铝溶液,开始生成氢氧化铝白色沉淀,继续滴加氢氧化钠,氢氧化铝与去氢氧化铝反应生成偏铝酸钠,白色沉淀溶解,故D符合,
故选D.
B.先生成氢氧化亚铁白色沉淀,氢氧化亚铁被氧化,迅速变为灰绿色,最终变为红褐色沉淀,故B不符合;
C.氯化钠溶液与硝酸银溶液反应生成氯化银白色沉淀,故C不符合;
D.将氢氧化钠溶液中滴入氯化铝溶液,开始生成氢氧化铝白色沉淀,继续滴加氢氧化钠,氢氧化铝与去氢氧化铝反应生成偏铝酸钠,白色沉淀溶解,故D符合,
故选D.
点评:本题考查元素化合物性质,明确物质的性质即可解答,铝盐与强碱反应现象与滴加顺序有关,滴加顺序不同,发生反应不同,实质是与量有关,难度不大.

练习册系列答案
相关题目
若溶液中由水电离产生的 c(OH-)=1×10-14mol?L-1,满足此条件的溶液中一定能够大量共存的离子组是( )
| A、K+、NH4+、SO42-、NO3- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、Al3+、Na+、NO3-、Cl- |
用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是( )
| A、6.9~7.1 |
| B、3.3~10.7 |
| C、4.3~9.7 |
| D、6~8 |
下列四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
| A、过量①与②分别与少量的锌(大小相同)反应时,开始时刻速率相同,反应中速率:①<② |
| B、将②、③两种溶液混合后,若呈中性,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、将③稀释a倍,将④稀释b倍,两溶液pH相等,则a<b倍 |
光导纤维的主要成分是( )
| A、纯硅 |
| B、玻璃 |
| C、纯SiO2 |
| D、硅酸盐 |
对于SO2的接触氧化反应,有学生绘制了如下四个图,其中正确的是( )
A、 |
B、 |
C、 |
D、 |
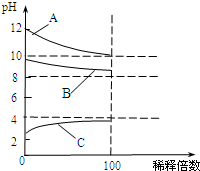 现有常温时浓度相同的五种电解质溶液:
现有常温时浓度相同的五种电解质溶液: 提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=