题目内容
用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是( )
| A、6.9~7.1 |
| B、3.3~10.7 |
| C、4.3~9.7 |
| D、6~8 |
考点:pH的简单计算
专题:
分析:误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足,此时锥形瓶溶液中溶质为NaCl和剩余的HCl,所以只要计算该溶液的pH值即可;
滴定误差在-0.1%,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可.
滴定误差在-0.1%,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可.
解答:
解:①滴定误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足,
此时锥形瓶溶液中溶质为NaCl和剩余的HCl,
剩余的氯化氢的物质的量为:n(HCl)=n(HCl)总-n(NaOH)=0.1×(100.0-99.9)×10-3=1×10-5(mol),
则反应完毕后溶液中氢离子浓度为:c(H+)=
=5×10-5mol/L,其pH为:pH=-lg[c(H+)]=lg5×10-5=5-lg5≈4.3;
②滴定误差为-0.1%,加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.1×(100.1-100.0)×10-3=1×10-5(mol),
此时溶液体积为:v=100.00+100.1=200.1mL=200.1×10-3(L),
所以混合液中氢氧根离子浓度为:c(OH-)=
mol/L≈5×10-5mol/L,
溶液中氢离子浓度为:c(H+)=
mol/L=2×10-10mol/L,此时溶液的pH=-lg[c(H+)]=10-lg2≈9.7,
所以反应完毕后溶液的pH变化范围为:4.3~9.7,
故选C.
此时锥形瓶溶液中溶质为NaCl和剩余的HCl,
剩余的氯化氢的物质的量为:n(HCl)=n(HCl)总-n(NaOH)=0.1×(100.0-99.9)×10-3=1×10-5(mol),
则反应完毕后溶液中氢离子浓度为:c(H+)=
| 1×10-5mol |
| 0.1L+0.1L |
②滴定误差为-0.1%,加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.1×(100.1-100.0)×10-3=1×10-5(mol),
此时溶液体积为:v=100.00+100.1=200.1mL=200.1×10-3(L),
所以混合液中氢氧根离子浓度为:c(OH-)=
| 1×10-5 |
| 0.2001 |
溶液中氢离子浓度为:c(H+)=
| 1×10-14 |
| 5×10-5 |
所以反应完毕后溶液的pH变化范围为:4.3~9.7,
故选C.
点评:本题考查了中和滴定中混合液pH的计算,题目难度稍大,明确“滴定误差在±0.1%以内”的含有为解答关键,注意掌握溶液酸碱性与溶液pH的计算方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列物质中,能使湿润的KI淀粉试纸变蓝的是( )
①溴水 ②碘酒 ③溴化钾 ④浓盐酸 ⑤氯化铁溶液.
①溴水 ②碘酒 ③溴化钾 ④浓盐酸 ⑤氯化铁溶液.
| A、①②⑤ | B、①②④⑤ |
| C、①④ | D、全部 |
有机物 正确的命名是( )
正确的命名是( )
 正确的命名是( )
正确的命名是( )| A、3,4,4-三甲基己烷 |
| B、3,3,4-三甲基己烷 |
| C、3,3-二甲基-4-乙基戊烷 |
| D、2,3,3-三甲基己烷 |
有机物甲是一种含有一个六元环结构的化合物,其分子式为C7H12O2,在酸性条件下可以发生水解,且水解产物只有一种,又知甲的分子中含有两个甲基,则甲的可能结构有( )
| A、6种 | B、8种 | C、10种 | D、9种 |
有下列四组物质,如果把某组物质中的后者逐滴加人到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是( )
| A、稀硫酸、氯化钡溶液 |
| B、硫酸亚铁溶液、氢氧化钠溶液 |
| C、氯化钠溶液、硝酸银溶液 |
| D、氯化铝溶液、氢氧化钠溶液 |
下列单质或化合物性质的描述正确的是( )
| A、NaHCO3的热稳定性大于Na2CO3 |
| B、SiO2与酸、碱均不反应 |
| C、常温下,NO易与空气中氧气发生化合反应 |
| D、氯化氢与氨气相遇,有大量的白雾生成 |
在10L密闭容器中,发生如下反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g).半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均反应速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A、υ(NH3)=0.0100mol?L-1?s-1 |
| B、υ(O2)=0.0010mol?L-1?S-1 |
| C、υ(NO)=0.0010mol?L-1?s-1 |
| D、υ(H2O)=0.045mol?L-1?s-1 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )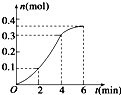

| A、反应在第2min到第4 min内生成CO2的平均反应速率为前2min的2倍 |
| B、反应开始4min内温度对反应速率的影响比浓度大 |
| C、反应速率先增大后减小 |
| D、反应开始2min内平均反应速率最大 |
