题目内容
6.原子团SCN化合价为-1价,在很多方面跟卤素原子相似,称为“拟卤素”.拟卤素离子与卤素离子还原性强弱顺序为Cl-<Br-<SCN-<I-.下列反应错误的是( )| A. | (SCN)2+2NaOH→NaSCN+NaSCNO+H2O | B. | (SCN)2+2NaBr→Br2+2NaSCN | ||
| C. | 4HSCN+MnO2→Mn(SCN)2+(SCN)2+2H2O | D. | (SCN)2+2KI→2KSCN+I2 |
分析 依据拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,可知:氧化性强弱顺序为:Cl2>Br2>(SCN)2>I2,结合氧化还原反应中强弱规律判断反应能否发生.
解答 解:依据拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,可知:氧化性强弱顺序为:Cl2>Br2>(SCN)2>I2,
A.氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以(SCN)2+2NaOH→NaSCN+NaSCNO+H2O能够发生,故A正确;
B.若(SCN)2+2NaBr→Br2+2NaSCN能够发生则氧化性,Br2<(SCN)2,与题干不符合,故B错误;
C.氧化性:Cl2>(SCN)2,二氧化锰能氧化氯离子生成氯气,则4H++2SCN-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++(SCN)2↑+2H2O,能够发生,故C正确;
D.氧化性:(SCN)2>I2,依据氧化还原反应强弱规律可知(SCN)2+2KI→2KSCN+I2,能够发生,故D正确;
故选:B.
点评 本题考查氧化还原反应,难度不大,明确离子的还原性顺序及其能够发生的反应是解本题关键,注意对知识的迁移应用,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
17. 如图所示的Mg~H2O2电池以海水为电解质溶液,可用于驱动无人驾驶的潜航器.该电池工作时,下列说法正确的是( )
如图所示的Mg~H2O2电池以海水为电解质溶液,可用于驱动无人驾驶的潜航器.该电池工作时,下列说法正确的是( )
 如图所示的Mg~H2O2电池以海水为电解质溶液,可用于驱动无人驾驶的潜航器.该电池工作时,下列说法正确的是( )
如图所示的Mg~H2O2电池以海水为电解质溶液,可用于驱动无人驾驶的潜航器.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的碱性增强 | D. | 溶液中Cl-向正极移动 |
15.下列反应的两种物质因为反应物用量不同或反应条件不同而生成不同的产物是( )
①Na和O2②S和O2③Al和NaOH④CO2和Ca(OH)2 ⑤Cu和HNO3⑥Fe和C12⑦Na2CO3和HCl.
①Na和O2②S和O2③Al和NaOH④CO2和Ca(OH)2 ⑤Cu和HNO3⑥Fe和C12⑦Na2CO3和HCl.
| A. | 全部 | B. | 除②、③、⑥外 | C. | 除②、④、⑦外 | D. | 除③、⑥、⑦外 |
1.室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为( )
| A. | 1.0×10-7mol•L-1 | B. | 1.0×10-6mol•L-1 | ||
| C. | 1.0×10-2mol•L-1 | D. | 1.0×10-12mol•L-1 |
18.下列叙述正确的是( )
| A. | 0.1 mol/L Na2CO3和NaHCO3的溶液中:二者的PH不同,但溶液中粒子种类相同 | |
| B. | pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后者 | |
| C. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降,Ksp(Ag2S)减小 | |
| D. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
15.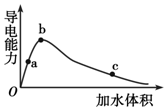 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b>a>c | |
| C. | 蘸取c点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别向a、b、c三点的溶液中,加入同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
16.紫外线作用下氧气可生成臭氧:3O2(g)?2O3(g),一定条件下反应达到平衡状态的标志是( )
| A. | 单位时间内生成2 mol O3,同时消耗3 mol O2 | |
| B. | O2的消耗速率0.3 mol•L-1•s-1,O3的消耗速率0.2 mol•L-1•s-1 | |
| C. | 容器内,2种气体O3、O2浓度相等 | |
| D. | 恒容时,密度不再发生变化,气体的平均相对分子质量也不再发生变化 |
 图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):
图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):