题目内容
7.NA为阿伏伽德罗常数的值,下列叙述正确的为( )| A. | 将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为 $\frac{a{N}_{A}}{14}$ | |
| B. | 1mol Cl2 通入水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| C. | 常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24升的甲烷中含有的C-H键数为0.4NA |
分析 A、过氧化钠和二氧化碳反应时,当1mol二氧化碳参与反应时,增重28g,转移1mol电子;
B、氯气通入水中后,和水的反应为可逆反应;
C、甲醛和冰醋酸的最简式均为CH2O;
D、甲烷所处的状态不明确.
解答 解:A、过氧化钠和二氧化碳反应时,当1mol二氧化碳参与反应时,增重28g,转移1mol电子,设当增重ag时,转移的电子的物质的量为xmol,则有:$\frac{28g}{ag}=\frac{1mol}{xmol}$,解得x=$\frac{a}{28}$mol,个数为$\frac{a}{28}{N}_{A}$个,故A错误;
B、氯气通入水中后,和水的反应为可逆反应,氯元素在溶液中的存在形式有Cl2、HClO、ClO-、Cl-,故有:2n(Cl2)+n(HClO)+n(Cl-)+n(ClO-)=2NA,故B错误;
C、甲醛和冰醋酸的最简式均为CH2O,故3g混合物中含有的CH2O的物质的量为0.1mol,个数为0.4NA个,故C正确;
D、甲烷所处的状态不明确,故其物质的量无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
18.常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
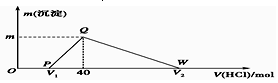

| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
15.已知Fe3O4 可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
| A. | O2是氧化剂,S2O32-、Fe2+ 是还原剂 | |
| B. | 当有1 mol Fe3O4生成时共转移的电子为4mol | |
| C. | 若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol | |
| D. | 若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol |
2.下列离子方程式中,不正确的是( )
| A. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaBO4↓+AlO2-+2H2O | |
| C. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
15.已知2H2(g)+O2(g)→2H2O(l)+571.6kJ,2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法正确的是( )
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
16.明矾是一种净水剂,明矾净水的原理是( )
| A. | Al3+有较强的吸附性 | |
| B. | Al3+与悬浮物生成沉淀 | |
| C. | Al3+与水反应生成的氢氧化铝胶体,具有吸附性 | |
| D. | 明矾难溶于水 |

 ,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.
,下图从A晶体结构图中分割出来的部分结构图,试判断符合A晶体结构图的是AD.