题目内容
1.下列说法正确的是( )| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
分析 A.过渡元素都是金属元素;
B.氢为非金属元素,第IIB族最外层含有2个电子;
C.原子晶体中含有共价键;
D.氧离子与钠离子具有相同的核外电子排布.
解答 解;A.过渡元素都是金属元素,非金属元素在主族和零族,故A正确;
B.氢为非金属元素,不属于碱金属,第IIB族最外层含有2个电子,最外层有两个电子的原子不一定在IIA 族,故B错误;
C.含离子键的晶体一定是离子晶体,含共价键的晶体可能是原子晶体,如金刚石,故C错误;
D.氧离子与钠离子具有相同的核外电子排布,属于两种不同的微粒,二者性质不同,故D错误;
故选:A.
点评 本题为综合题,考查了非金属性强弱的判断依据,离子键的定义,原子核外电子排布规律,题目难度不大,熟悉相关知识即可解答.

练习册系列答案
相关题目
11.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解.当加碱调节pH为2.7时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果和原因是Zn2+和Fe2+分离不开,Fe(OH)2和Zn(OH)2的Ksp相近.(lg2=0.3 lg3=0.48)
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
12.下列事实中,不能用化学平衡移动(勒夏特列)原理解释的是( )
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
6.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | CH3OH的燃烧热为676.7 kJ•mol-1 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
13.如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )

| A. | ①<②<③<④ | B. | ①<③<②<④ | C. | ②<①<④<③ | D. | ①<②<④<③ |
11.在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.6 kJ/mol | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6 kJ/mol |

 .
. .
.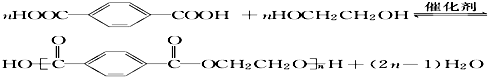 .
. 的合成路线(部分反应条件略去)如图所示.
的合成路线(部分反应条件略去)如图所示.

 ,D→E的反应类型为取代反应或水解反应.
,D→E的反应类型为取代反应或水解反应. .
.  中最多有10个原子共平面,
中最多有10个原子共平面, 发生缩聚反应生成有机物的结构简式为
发生缩聚反应生成有机物的结构简式为 .
. (写结构简式).
(写结构简式).