题目内容
19.精制氯化钾在工业上可用于制备各种含钾的化合物.完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42-、Br-等杂质离子,可按如下步骤进行精制,完成各步内容.
①溶解;②加入试剂至Fe3+、SO42-沉淀完全,煮沸;③过滤;④加入盐酸调节pH;⑤通入足量的Cl2(除Br-);⑥蒸干灼烧.
步骤②中,依次加入的沉淀剂是NH3•H2O、BaCl2、K2CO3.
证明Fe3+已沉淀完全的操作是取样,滴加KSCN溶液,无明显现象.
(2)有人尝试用工业制纯碱原理来制备K2CO3.他向饱和KCl溶液中依次通入足量的NH3和CO2两种气体,充分反应后有白色晶体析出.将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊.
写出生成白色晶体的化学方程式:NH3+CO2+H2O=NH4HCO3↓.
分析该方法得不到K2CO3的原因可能是KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出.
(3)用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法.氢氧化钾在阴极区产生.为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止阴(填“阴”、“阳”或“所有”)离子通过.
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法.其反应可分为5步(若干步已合并,条件均省略).请写出第⑤步反应的化学方程式.
第①、②步(合并):2KCl+4HNO3→2KNO3+Cl2+2NO2+2H2O
第③、④步(合并):4KNO3+2H2O→4KOH+4NO2+O2
第⑤步:4NO2+O2+2H2O→4HNO3
总反应:4KCl+O2+2H2O→4KOH+2Cl2与电解法相比,该方法的优势可能是能耗低(节能).
分析 (1)氯化钾中含有Fe3+、SO42-、Br-等杂质离子,将样品溶解后先加入NH3•H2O除去铁离子、再加入氯化钡除去硫酸根离子,再加入碳酸钾溶液除去钡离子,煮沸得氢氧化铁沉淀和硫酸钡、碳酸钡,过滤,滤液中加入盐酸调节pH值,通入足量的氯气,置换出溴离子,蒸干灼烧得氯化钾,根据Fe3+与KSCN溶液会出现血红色,可以证明Fe3+沉淀完全;
(2)根据工业制纯碱原理可知,向饱和KCl溶液中依次通入足量的氨气和二氧化碳,得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊,则得到的固体应为碳酸氢铵,得不到K2CO3的原因可能是KHCO3溶解度大于NH4HCO3,所以固体先析出NH4HCO3;
(3)电解氯化钾溶液阳极上是溶液中氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,氢氧根离子浓度增大,氢氧化钾在阴极区产生;
(4)用氯化钾制氢氧化钾,根据反应2KCl+4HNO3→2KNO3+Cl2+2NO2+2H2O及4KNO3+2H2O→4KOH+4NO2+O2可知,再将二氧化氮和氧气转化成硝酸即可得总反应4KCl+O2+2H2O→4KOH+2Cl2,根据这一方法中的能耗答题.
解答 解:(1)氯化钾中含有Fe3+、SO42-、Br-等杂质离子,将样品溶解后先加入NH3•H2O除去铁离子、再加入氯化钡除去硫酸根离子,再加入碳酸钾溶液除去钡离子,煮沸得氢氧化铁沉淀和硫酸钡、碳酸钡,过滤,滤液中加入盐酸调节pH值,通入足量的氯气,置换出溴离子,蒸干灼烧得氯化钾,根据Fe3+与KSCN溶液会出现血红色,可以证明Fe3+沉淀是否完全,其操作为取样,滴加KSCN溶液,无明显现象,证明Fe3+已沉淀完全,
故答案为:过滤;通入足量的Cl2; BaCl2;K2CO3;取样,滴加KSCN溶液,无明显现象;
(2)根据工业制纯碱原理可知,向饱和KCl溶液中依次通入足量的氨气和二氧化碳,得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊,则得到的固体应为碳酸氢铵,反应的方程式为NH3+CO2+H2O→NH4HCO3↓,得不到K2CO3的原因可能是KHCO3溶解度大于NH4HCO3,所以固体先析出NH4HCO3,
故答案为:NH3;CO2;NH3+CO2+H2O→NH4HCO3↓;KHCO3溶解度较大(大于NH4HCO3),无法从溶液中析出;
(3)用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法.阳极上是溶液中氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,氢氧根离子浓度增大,氢氧化钾在阴极区产生,为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止阴离子通过,
故答案为:阴;阴;
(4)用氯化钾制氢氧化钾,根据反应2KCl+4HNO3=2KNO3+Cl2+2NO2+2H2O及4KNO3+2H2O=4KOH+4NO2+O2可知,再将二氧化氮和氧气转化成硝酸即可得总反应4KCl+O2+2H2O=4KOH+2Cl2,所以第⑤步反应为4NO2+O2+2H2O=4HNO3,在这一方法中的能耗低(节能),
故答案为:4NO2+O2+2H2O=4HNO3;能耗低(节能).
点评 本题主要考查了混合物的分离和提纯,难度中等,注意常见元素化合物知识与化学实验基本操作的灵活运用.

| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
| 选项 | 比较 | 碳循环 | 硫循环 |
| A | 异 | 碳元素会进入大气 | 硫元素不会进入大气 |
| B | 碳元素可以有机物形式参与循环 | 硫元素都以无机物形式参与循环 | |
| C | 同 | 人类活动对碳循环和硫循环都造成了巨大影响 | |
| D | 碳循环和硫循环对环境的影响是都能形成酸雨 | ||
| A. | A | B. | B | C. | C | D. | D |
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
| A. | m=2x | B. | m<2x | C. | m>2x | D. | 无法判断 |
| A. | 粘土 | B. | 石灰石 | C. | 纯碱 | D. | 石英 |
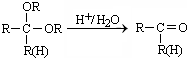
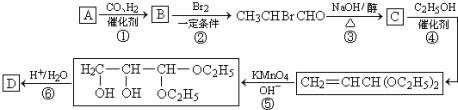
 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.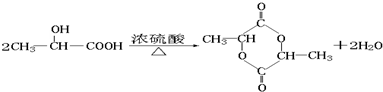 .
.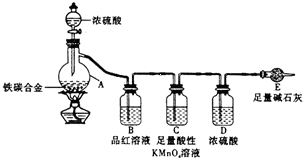 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.