题目内容
4.下列各组物质不互为同分异构体的是( )| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
分析 同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:A.NH4CNO和CO(NH2)2的分子式都为CH4N2O,二者结构不同,属于同分异构体,故A正确;
A.CH2OHCHO和CH3COOH的分子式都为C2H4O2,二者结构不同,属于同分异构体,故B正确;
A.CH3OOCCH3和CH3COOCH3的分子式都为CH4N2O,二者结构相同,属于同种物质,故C错误;
A.甘氨酸(NH2CH2COOH)和CH3 CH2NO2的分子式都为C2H5NO2,二者结构不同,属于同分异构体,故D正确;
故选C.
点评 本题考查了同分异构体的判断,难度不大,侧重对基础知识的巩固,根据物质名称确定结构是关键.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
12.把含有氧化铁的铁丝投入足量的稀硫酸中,直到固体全部溶解.经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的H2的物质的量之比为3:1.则原混合物中氧化铁与铁的物质的量之比为( )
| A. | 1:2 | B. | 2:5 | C. | 3:2 | D. | 4:1 |
16.“碘钟”实验中,3I-(aq)+S2O82-(aq)?I3-(aq)+2SO42- (aq)的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下表:
(1)写出反应的平衡常数表达式K=$\frac{c({{I}_{3}}^{-})•{c}^{2}(S{{O}_{4}}^{2-})}{{c}^{3}({I}^{-})•c({S}_{2}{{O}_{8}}^{2-})}$.
(2)反应中发生反应的I-与被氧化的I-的物质的量比为3:2.
(3)该实验的目的是研究I-、S2O82-浓度对反应速率的影响;显色时间t1=22s;若c(I-)=0.64mol/L,c(S2O82-)=0.02mol/L,请估算该反应显色的时间应为11s.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c( S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
(2)反应中发生反应的I-与被氧化的I-的物质的量比为3:2.
(3)该实验的目的是研究I-、S2O82-浓度对反应速率的影响;显色时间t1=22s;若c(I-)=0.64mol/L,c(S2O82-)=0.02mol/L,请估算该反应显色的时间应为11s.
13.深红色气体氧化剂红氧的化学式为O8,在相同条件下,等物质的量的O8和O4具有相同的( )
| A. | 原子数 | B. | 质量 | C. | 密度 | D. | 分子数 |
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.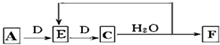

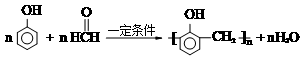 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.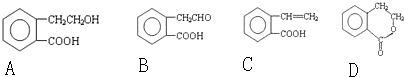
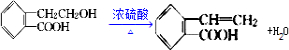 .
.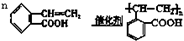 .
.
