题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,1L0.1mol/L的Na2CO3溶液中含有CO32-和HCO3-离子数之和为0.1NA | |
| B. | 标准状况下,11.2L丙烷中含有的极性共价键数目为4NA | |
| C. | 向Fel2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子数目为NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
分析 A.依据溶液中物料守恒计算分析,碳酸根离子分步水解生成碳酸氢根离子和碳酸;
B.n=$\frac{V}{22.4L/mol}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,丙烷分子中含有的极性共价键为8;
C.向Fel2溶液中通入适量Cl2,1molFe2+被氧化可能是指氧化亚铁离子,也可能是氧化亚铁离子和碘离子;
D.标准状况下,22.4LCl2物质的量=n=$\frac{V}{22.4L/mol}$=$\frac{22.4L}{22.4L/mol}$=1mol,氯气自身氧化还原反应,氯元素化合价0价变化为-1价和+1价.
解答 解:A.依据溶液中物料守恒计算分析,碳酸根离子分步水解生成碳酸氢根离子和碳酸,常温下,1L0.1mol/L的Na2CO3溶液中含有CO32-、H2CO3、HCO3-微粒数之和为0.1NA,故A错误;
B.n=$\frac{V}{22.4L/mol}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,丙烷分子C3H8,0.5mol分子中含有的极性共价键为8×0.5mol×NA=4NA,故B正确;
C.向Fel2溶液中通入适量Cl2,1molFe2+被氧化可能是指氧化亚铁离子,也可能是氧化亚铁离子和碘离子,转移电子数不一定为NA,故C错误;
D.标准状况下,22.4LCl2物质的量=n=$\frac{V}{22.4L/mol}$=$\frac{22.4L}{22.4L/mol}$=1mol,氯气自身氧化还原反应,氯元素化合价0价变化为-1价和+1价,电子转移为NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析,主要是电解质溶液中物料守恒、分子结构、氧化还原反应定量计算和电子转移计算等,掌握基础是解题关键,题目难度中等.

| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 水和氯化钠的电解 |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与4molNaOH恰好完全反应 | ||
| C. | 易发生水解反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
(1)请写出氨气与水反应的化学方程式,并据此推断氨水中含有哪些分子(用化学式表示).
(2)氨水中哪些物质能发生电离?请写出电离方程式,并据此分析氨水中存在的离子.
| A. | 小苏打常用于配制波尔多液 | B. | 氮气、氨和干冰常用作制冷剂 | ||
| C. | Fe3O4常用作红色油漆和涂料 | D. | Na2O常用作呼吸面具中氧气的来源 |
| A. | 将过量二氧化硫通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
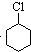 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$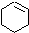 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$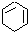 $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
.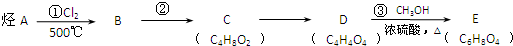
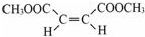 ;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
 .
.