题目内容
关于如图所示的原电池,下列说法正确的是( )
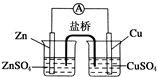

| A、锌电极发生还原反应,铜电极发生氧化反应 |
| B、盐桥中的阴离子向硫酸铜溶液中迁移 |
| C、电子从锌电极通过电流计流向铜电极 |
| D、铜电极上发生的电极反应为2H++2e-═H2↑ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,Zn易失电子作负极、Cu作正极,正、负极电极反应式分别为Cu2++2e-=Cu、Zn-2e-=Zn2+,电子从负极沿导线流向正极,盐桥中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答:
解:A.锌失电子发生氧化反应,铜电极上得电子发生还原反应,故A错误;
B.锌作负极、铜作正极,则盐桥中阴离子向硫酸锌溶液迁移,故B错误;
C.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故C正确;
D.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D错误;
故选C.
B.锌作负极、铜作正极,则盐桥中阴离子向硫酸锌溶液迁移,故B错误;
C.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故C正确;
D.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D错误;
故选C.
点评:本题考查了原电池原理,明确正负极上发生的反应、电子及离子移动方向即可解答,注意电子不能进入电解质溶液,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关说法正确的是( )
| A、合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| B、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| C、100 mL pH=3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱 |
| D、Fe2+与[Fe(CN)6]3-反应生成红色的铁氰化亚铁沉淀 |
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
A、该反应的化学方程式为CO+H2O
| |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
| D、该反应的焓变为正值 |
金属钠着火时,可采用的灭火物质是( )
| A、泡沫灭火器 | B、水 |
| C、煤油 | D、沙子 |
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
| A、Ba(NO3)2、K2CO3、AgNO3、HNO3 |
| B、K2CO3、Ba(NO3)2、AgNO3、HNO3 |
| C、Ba(NO3)2、K2CO3、HNO3、AgNO3 |
| D、AgNO3、Ba(NO3)2、K2CO3、HNO3 |
对于可逆反应2A+3B?2C,下列条件的改变一定可以加快反应速率的是( )
| A、增大压强 |
| B、增加A的量 |
| C、升高温度 |
| D、加入MnO2 |
将 Al、CuO、Fe2O3组成的混合物共10.0g放入50mL稀硫酸中,混合物完全溶解,当再加入50mL 2.00mol/L的NaOH溶液时,得到沉淀最多.上述硫酸溶液的浓度为( )
| A、0.500 mol/L |
| B、1.00 mol/L |
| C、2.00 mol/L |
| D、3.00 mol/L |
下列有关Na2CO3和NaHCO3的说法中,错误的是( )
| A、等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B、等物质的量的Na2CO3和NaHCO3分别与相同浓度相同体积的盐酸反应,NaHCO3反应更剧烈 |
| C、向Na2CO3溶液中滴加酚酞溶液,溶液变红 |
| D、可用BaCl2溶液鉴别Na2CO3溶液和NaHCO3溶液 |