题目内容
将 Al、CuO、Fe2O3组成的混合物共10.0g放入50mL稀硫酸中,混合物完全溶解,当再加入50mL 2.00mol/L的NaOH溶液时,得到沉淀最多.上述硫酸溶液的浓度为( )
| A、0.500 mol/L |
| B、1.00 mol/L |
| C、2.00 mol/L |
| D、3.00 mol/L |
考点:化学方程式的有关计算
专题:计算题
分析:Al、CuO、Fe2O3组成的混合物共与硫酸反应生成氯硫酸铝、硫酸铜、硫酸铜,硫酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为硫酸钠,根据钠离子守恒有2n(Na2SO4)=n(NaOH),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),再根据c=
计算.
| n |
| V |
解答:
解:Al、CuO、Fe2O3组成的混合物共与硫酸反应生成氯硫酸铝、硫酸铜、硫酸铜,硫酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为硫酸钠,根据钠离子守恒有2n(Na2SO4)=n(NaOH),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),故n(H2SO4)=
n(NaOH)=
×0.05L×2mol/L=0.05mol,则:c(H2SO4)=
=1mol/L,
故选B.
| 1 |
| 2 |
| 1 |
| 2 |
| 0.05mol |
| 0.05L |
故选B.
点评:本题考查混合物的有关计算,难度中等,理解反应过程根据离子守恒计算是关键,侧重对学生思维能力的考查.

练习册系列答案
相关题目
下列反应中反应物的总能量比生成物低的是( )
| A、盐酸与氢氧化钠反应 |
| B、铁和稀硫酸的反应 |
| C、氢氧化钡晶体的粉末和氯化铵晶体混合 |
| D、木炭在氧气中燃烧 |
关于如图所示的原电池,下列说法正确的是( )
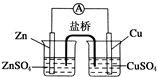

| A、锌电极发生还原反应,铜电极发生氧化反应 |
| B、盐桥中的阴离子向硫酸铜溶液中迁移 |
| C、电子从锌电极通过电流计流向铜电极 |
| D、铜电极上发生的电极反应为2H++2e-═H2↑ |
对于反应2A(g)+B(g)?2C(g)△H<0,下图图象正确的是( )
A、 |
B、 |
C、 |
D、 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、放热反应的反应速率总是大于吸热反应的反应速率 |
| B、同温同压下,反应H2(g)+Cl2(g)═2HCl (g)在光照和点燃条件下的△H相同 |
| C、甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式为 CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol |
| D、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
下列物质,不属于混合物的是( )
| A、汽油 | B、石蜡 |
| C、三氯甲烷 | D、裂解气 |
下列各组顺序的排列不正确的是( )
| A、酸性强弱:HClO4>H2SO4>H3PO4 |
| B、离子半径:Na+>Mg2+>Al3+>F- |
| C、热稳定性:HCl>H2S>PH3>SiH4 |
| D、碱性强弱:NaOH>Mg(OH)2>Al(OH)3 |
1L丙烷与xLO2混合点燃,丙烷充分反应后,生成的混合气体的体积为aL(气体体积均在120℃,101kPa时测定).将aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL.若a-b=6,则x的值为( )
| A、4 | B、4.5 | C、5 | D、5.5 |
在下列物质:①K2SO4、②甲醛、③MgSO4、④NH4Cl、⑤KOH、⑥Hg(NO3)2中,能使蛋白质变性的是( )
| A、②④⑥ | B、①③⑤ |
| C、②③⑥ | D、②⑤⑥ |