题目内容
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
A、该反应的化学方程式为CO+H2O
| |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
| D、该反应的焓变为正值 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数K=
,所以该反应化学方程式应为CO2+H2?CO+H2O,恒容时,温度升高,H2 浓度减小,平衡向正反应移动,则该反应为吸热反应,以此来解答.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
解答:
解:A、由平衡常数可知,该反应为CO2+H2?CO+H2O,故A错误;
B、恒温恒容下,若通入氢气,增大压强,则H2浓度增大,故B错误;
C、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡正向移动,故C错误.
D、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故D正确;
故选D.
B、恒温恒容下,若通入氢气,增大压强,则H2浓度增大,故B错误;
C、升高温度,正、逆反应速率都增大,正反应速率增大更多,平衡正向移动,故C错误.
D、恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故D正确;
故选D.
点评:本题考查化学平衡常数、影响化学平衡的因素等,难度中等,注意对化学平衡常数的理解,同一反应化学计量数不同平衡常数不同.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 如图实验制取少量的Fe(OH)3胶体 |
B、 如图实验试管中溶液吸收NH3,并防止倒吸 |
C、 如图实验用H2SO4标准溶液滴定NaOH溶液 |
D、 可用如图实验装置除去CO2气体中含有的少量HCl杂质 |
下列反应中反应物的总能量比生成物低的是( )
| A、盐酸与氢氧化钠反应 |
| B、铁和稀硫酸的反应 |
| C、氢氧化钡晶体的粉末和氯化铵晶体混合 |
| D、木炭在氧气中燃烧 |
常温下,现有溶液中溶质的物质的量浓度均为0.01mol?L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是( )
| A、pH由小到大的顺序是①<②<③<④ |
| B、溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③ |
| C、取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③ |
| D、取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9 |
下列说法中不正确的是( )
| A、Na,Mg,Al金属性依次减弱 |
| B、HCl,H2S,PH3稳定性依次减弱 |
| C、NaOH,KOH,CsOH碱性依次减弱 |
| D、S2-,Cl-,Ca2+半径依次减小 |
下列有关电解质溶液的说法正确的是( )
| A、在蒸馏水中滴加浓H2SO4或者Na2CO3溶液,KW均不变 |
| B、向某氨水中加入一定浓度的稀硫酸至溶液呈中性,混合溶液中离子存在关系式: c(SO42-)=c(NH4+)>c(H+)=c(OH-) |
| C、NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| D、在Na2S 稀溶液中,c(H+)<c(OH-)-c(H2S)-c(HS-) |
关于如图所示的原电池,下列说法正确的是( )
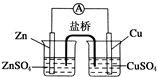

| A、锌电极发生还原反应,铜电极发生氧化反应 |
| B、盐桥中的阴离子向硫酸铜溶液中迁移 |
| C、电子从锌电极通过电流计流向铜电极 |
| D、铜电极上发生的电极反应为2H++2e-═H2↑ |
对于反应2A(g)+B(g)?2C(g)△H<0,下图图象正确的是( )
A、 |
B、 |
C、 |
D、 |