题目内容
对于可逆反应2A+3B?2C,下列条件的改变一定可以加快反应速率的是( )
| A、增大压强 |
| B、增加A的量 |
| C、升高温度 |
| D、加入MnO2 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:决定化学反应速率快慢的因素有内因和外因,反应物本身的性质(内因),温度、浓度、压强、催化剂等为影响化学反应速率的外界因素,根据每个因素的使用条件来回答.
解答:
解:A.对固体或液体之间的反应,改变压强不会引起化学反应速率的变化,故A错误;
B.对于反应2A+3B?2C,如果A是固体,增加A的量不会引起速率的变化,故B错误;
C.升高体系的温度,所有化学反应的反应速率均加快,故C正确;
D.MnO2不一定为该反应的催化剂,不一定能加快反应的速率,故D错误.
故选C.
B.对于反应2A+3B?2C,如果A是固体,增加A的量不会引起速率的变化,故B错误;
C.升高体系的温度,所有化学反应的反应速率均加快,故C正确;
D.MnO2不一定为该反应的催化剂,不一定能加快反应的速率,故D错误.
故选C.
点评:本题考查化学反应速率的影响因素,侧重于学生的分析能力的考查,为高考高频考点,注意把握影响反应速率的因素,注重相关知识的学习与积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
钠硫高能蓄电池的结构如右下图,M为Na2O和Al2O3的混合物,电池的反应原理为2Na+xS?Na2Sx,电池工作温度为320℃.下列说法错误的是( )

| A、Na电极为电池负极,S电极为电池正极 | ||
B、电池放电时,正极反应为xS+2e-═S
| ||
| C、电池充电时.Na所在电极连接电源正极 | ||
| D、M的作用为导电和隔离钠和硫 |
下列说法中不正确的是( )
| A、Na,Mg,Al金属性依次减弱 |
| B、HCl,H2S,PH3稳定性依次减弱 |
| C、NaOH,KOH,CsOH碱性依次减弱 |
| D、S2-,Cl-,Ca2+半径依次减小 |
关于如图所示的原电池,下列说法正确的是( )
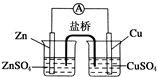

| A、锌电极发生还原反应,铜电极发生氧化反应 |
| B、盐桥中的阴离子向硫酸铜溶液中迁移 |
| C、电子从锌电极通过电流计流向铜电极 |
| D、铜电极上发生的电极反应为2H++2e-═H2↑ |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A、c(NH4+):③>② |
| B、pH:①>②>③ |
| C、Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)向溶解方向移动 |
| D、等体积①和③混合溶液中 c(Cl-)>c(NH4+)>c(H+)>c(CH3COO-)>c(OH-) |
对于反应2A(g)+B(g)?2C(g)△H<0,下图图象正确的是( )
A、 |
B、 |
C、 |
D、 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、放热反应的反应速率总是大于吸热反应的反应速率 |
| B、同温同压下,反应H2(g)+Cl2(g)═2HCl (g)在光照和点燃条件下的△H相同 |
| C、甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式为 CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol |
| D、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
下列各组顺序的排列不正确的是( )
| A、酸性强弱:HClO4>H2SO4>H3PO4 |
| B、离子半径:Na+>Mg2+>Al3+>F- |
| C、热稳定性:HCl>H2S>PH3>SiH4 |
| D、碱性强弱:NaOH>Mg(OH)2>Al(OH)3 |
用CH4催化还原NOx,可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1
下列说法不正确的是( )
| A、若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
| B、由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574 kJ?mol-1 |
| C、反应①②转移的电子数相同 |
| D、反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol |