题目内容
18.在1200℃时,天然气脱硫工艺中会发生下列反应,则△H4的正确表达式为( )①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3④S(g)=$\frac{1}{2}$S2(g)△H4.
| A. | △H4=$\frac{1}{3}$(3△H3-△H1-△H2) | B. | △H4=$\frac{1}{3}$(△H1+△H2-3△H3) | ||
| C. | △H4=$\frac{3}{4}$(△H1+△H2-3△H3) | D. | △H4=$\frac{3}{4}$(△H1-△H2-3△H3) |
分析 由①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3
结合盖斯定律可知,(①+②-③×3)×$\frac{2}{3}$得到2S(g)=S2(g),且物质的量与热量成正比,以此来解答.
解答 解:由①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3
结合盖斯定律可知,(①+②-③×3)×$\frac{2}{3}$得到2S(g)=S2(g),则2S(g)=S2(g)△H4=$\frac{2}{3}$ (△H1+△H2-3△H3),
可知④S(g)=$\frac{1}{2}$S2(g)△H4=$\frac{2}{3}$ (△H1+△H2-3△H3)×$\frac{1}{2}$=$\frac{1}{3}$(△H1+△H2-3△H3),
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应的关系、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意已知反应与目标反应的关系,题目难度不大.

练习册系列答案
相关题目
17.有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl -、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有 Al3+、Mg2+、HCO3- | B. | 肯定有 Al3+、Mg2+ | ||
| C. | 肯定没有HCO3-、MnO4-、NH4+、K+ | D. | 能确定K+、Cl-是否存在 |
18.A、B、C、D、E、F均为短周期主族元素,它们的原子序数依次增大,其中A的阴离子的核外电子数与B、C、D 原子的核外内层电子数相同.B的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产D的单质,E的原子序数为D的两倍.根据以上叙述,下列说法中正确的是( )
| A. | 上述六种元素的原子半径大小为A<B<C<D<F<E | |
| B. | A、B、D三种元素可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | A、B、C、F原子的核外最外层电子数的总和为18 | |
| D. | 由A与B组成的化合物的沸点一定低于由A与D组成的化合物的沸点 |
13.下列反应既是化合反应又是氧化还原反应的是( )
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | Na2CO3+CO2+H2O═2NaHCO3 | ||
| C. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | D. | NH4HS$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2S↑ |
10.合成高分子材料因有优良的性能而大受欢迎,因此高分子材料合成是化学工业中的最重要产业.与一般金属材料相比,其优点是( )
| A. | 硬度高,热稳定性强 | B. | 耐热性好,耐磨性强 | ||
| C. | 导电性强,延展性好 | D. | 强度大,电绝缘性好 |
7.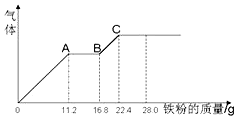 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原溶液中H2SO4浓度为4mol•L-1 | |
| B. | 图中,AB段的反应为2Fe3++Fe=3Fe2+,A点的溶质为Fe(NO3)3 | |
| C. | 原混合液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生是NO,BC段产生的气体是氢气 |
8.下列事实不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 相对分子质量:Ar>K | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |

 .
.