题目内容
12.甲酸是一种一元有机酸.下列性质可以证明它是弱电解质的是( )| A. | 甲酸能与水以任意比互溶 | |
| B. | 1 mol•L-1甲酸溶液的pH约为2 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比盐酸溶液的弱 |
分析 只要能证明甲酸在水溶液部分电离就能说明甲酸是弱电解质,据此分析解答.
解答 解:A.甲酸能与水以任意比互溶,与甲酸的电离程度无关,所以不能证明甲酸是弱电解质,故A错误;
B.1mol/L甲酸溶液的pH约为2,甲酸溶液中氢离子浓度小于甲酸,说明甲酸部分电离,则证明甲酸是弱电解质,故B正确;
C.10mL 1mol•L-1甲酸恰好与10mL 1mol•L-1NaOH溶液完全反应,说明甲酸是一元酸,不能说明甲酸的电离程度,则不能证明甲酸是弱电解质,故C错误;
D.溶液的导电性与离子浓度成正比,与电解质强弱无关,所以不能说明甲酸是弱电解质,故D错误;
故选B.
点评 本题考查了电解质强弱的判断,电解质强弱是根据其电离程度划分的,与其溶解性、酸碱性、溶液导电能力都无关,题目难度不大

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 甲苯的一氯取代物有三种同分异构体,它们的熔沸点各不相同 | |
| B. | CH2O2和C2H4O2分子组成上相差一个CH2,所以互为同系物 | |
| C. | 乙醛分别与O2,银氨溶液,新制氢氧化铜反应,均体现了乙醛的还原性 | |
| D. | 淀粉,纤维素,蛋白质都属于天然高分子化合物,可作为人体的供能物质 |
12.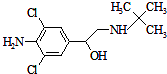 克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )
克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )
 克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )
克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )| A. | 该有机物的分子式为C12H18Cl2N2O | |
| B. | 1mol该有机物中含有3mol碳碳双键 | |
| C. | 该有机物中至少有15个原子在同一平面内 | |
| D. | 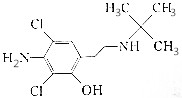 和该有机物互为同分异构体 和该有机物互为同分异构体 |
7.铊是超导材料的组成元素之一,铊位于第六周期ⅢA族,元素符号是Tl.以下对铊的性质推断中肯定不正确的是( )
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价的离子化合物 | ||
| C. | 能与H+反应生成H2 | D. | Tl3+的氧化性比Al3+强 |
17.下列不能使有色布条褪色的物质是( )
| A. | 漂白粉溶液 | B. | 食盐水 | C. | 氯水 | D. | 次氯酸钠溶液 |
4.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 2L 0.5mol/L 的 NaClO 溶液中含有 ClO-离子总数为 NA | |
| D. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为2NA |
1.氢元素与其他元素形成的二元化合物称为氢化物.下面关于氢化物的叙述正确( )
| A. | D2O与H2O是同位素 | B. | SiH4的稳定性>CH4的稳定性 | ||
| C. | 氢氟酸的酸性>盐酸的酸性 | D. | NaH是离子化合物 |
2.能够用键能的大小作为主要依据来解释的是( )
| A. | CO2是直线形分子 | |
| B. | 稀有气体一般难发生化学反应 | |
| C. | 空气中氮气的化学性质比氧气稳定 | |
| D. | 常温常压下氯气呈气态而溴单质呈液态 |
 ;C气体的化学式是SO2.
;C气体的化学式是SO2.