题目内容
14.某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色;A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色.请回答下列问题:(1)B气体的电子式
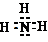 ;C气体的化学式是SO2.
;C气体的化学式是SO2.(2)化合物A受热容易分解,写出A受热分解的化学反应方程式:(NH4)2SO3═NH3↑+SO2↑+H2O.
(3)工业排放的C气体会污染环境,通常用过量的B的水溶液吸收,请写出相关的离子方程式:SO2+2NH3•H2O═2NH4++SO32-+H2O.
(4)利用互补金属氧化物半导体与气体接触时电阻或功函数发生变化的这一特性,可以制成气体传感器,用来检测各种气体.其中Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成.写出该反应的化学方程式:3Fe2O3+2NH3═6FeO+N2+3H2O.
(5)将B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液.那么D的化学式是NH4NO3,原混合气体中,B气体和氧气的体积比是1:1.
分析 某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色,推断B为NH3,A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色,推断C为SO2,则A为亚硫酸铵,
(1)B为NH3属于共价化合物,氮原子和氢原子形成三个共价键,C为二氧化硫;
(2)化合物A受热分解生成氨气、二氧化硫和水;
(3)B的水溶液为一水合氨溶液,二氧化硫是酸性氧化物,和一水合氨反应生成亚硫酸铵和水;
(4)Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成,氧化铁变化为氧化亚铁,氮元素化合价-3价变化为0价,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(5)B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液,判断为NH4NO3的水溶液氨气催化氧化生成一氧化氮和水,一氧化氮和氧气和水反应生成硝酸,硝酸和氨气生成硝酸铵,据此书写化学方程式.
解答 解:某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色,推断B为NH3,A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色,推断C为SO2,则A为亚硫酸铵,
(1)B为NH3属于共价化合物,氮原子和氢原子形成三个共价键,电子式为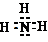
故答案为: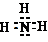
(2)化合物A受热分解生成氨气、二氧化硫和水,反应的化学方程式为(NH4)2SO3═NH3↑+SO2↑+H2O,
故答案为:(NH4)2SO3═NH3↑+SO2↑+H2O;
(3)B的水溶液为一水合氨溶液,二氧化硫是酸性氧化物,和一水合氨反应生成亚硫酸铵和水,反应的离子方程式为:SO2+2NH3•H2O═2NH4++SO32-+H2O,
故答案为:SO2+2NH3•H2O═2NH4++SO32-+H2O;
(4)Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成,氧化铁变化为氧化亚铁,氮元素化合价-3价变化为0价,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式为:3Fe2O3+2NH3═6FeO+N2+3H2O,
故答案为:3Fe2O3+2NH3═6FeO+N2+3H2O;
(5)B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液,判断为NH4NO3的水溶液,氨气催化氧化生成一氧化氮和水,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,一氧化氮和氧气和水反应生成硝酸,4NO+3O2+2H2O=4HNO3,反应的化学方程式为:2NH3+2O2=NH4NO3+H2O,B气体和氧气的体积比是1:1,
故答案为:NH4NO3;1:1.
点评 本题考查了无机物质转化的关系推断,主要是物质性质和反应产物的理解应用,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 小苏打与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| B. | 向烧碱溶液中通入过量的CO2 CO2+2OH-═CO32-+H2O | |
| C. | 小粒钠投入冷水中 2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++3NO3-═Ag++NO↑+2H2O |
| 实验内容 | 实验目的 | |
| A | 将AlCl3溶液蒸干灼烧 | 制备Al2O3 |
| B | 向淀粉水解后的溶液中,依次加入NaOH溶液、新制Cu(OH)2,共热 | 探究水解产物的还原性 |
| C | 向某溶液中加入稀硫酸,将产生的气体通入澄清石灰水 | 检验该溶液中是否含有CO32- |
| D | 向H2O2溶液中滴加少量FeCl3溶液 | 探究催化剂对化学反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 所得溶液中氯化钠的浓度为1 mol/L | |
| B. | 向所得的溶液中通入二氧化碳,可使溶液具备漂白性 | |
| C. | 所得溶液中有大量的单质的氯元素存在 | |
| D. | 在反应中氯元素化合价降低,钠元素化合价升高 |
| A. | 室温下,通过用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,半分钟不变色 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
| A. | 甲酸能与水以任意比互溶 | |
| B. | 1 mol•L-1甲酸溶液的pH约为2 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比盐酸溶液的弱 |
 ).
).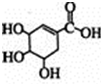 +Br2→
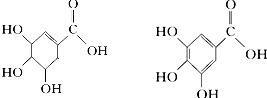
+Br2→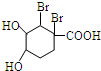 .
.
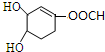 .
.