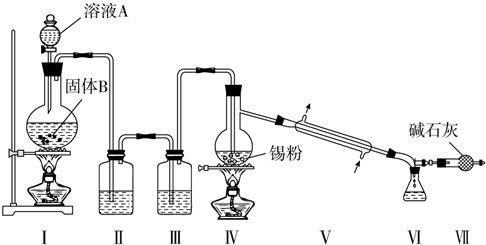
题目内容
9.V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为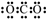 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的物质为离子化合物,既含有离子键又含有非极性键 |
分析 V、W、X、Y均是元素周期表中短周期元素,V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成,则V为N,甲为氨气,W为Cl,乙为HCl,Y为C,X为Al,结合元素周期律及元素化合物知识来解答.
解答 解:V、W、X、Y均是元素周期表中短周期元素,V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成,则V为N,甲为氨气,W为Cl,乙为HCl,Y为C,X为Al,
A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:X>W>Y>V,故A错误;
B.Y的最高价氧化物为二氧化碳,其电子式为 ,故B错误;
,故B错误;
C.X的最高价氧化物为氧化铝,具有两性,能与V、W最高价氧化物对应的水化物(硝酸、高氯酸)反应,故C正确;
D.甲、乙混合时所生成的物质为离子化合物为氯化铵,既含有离子键又含有N-H极性键,故D错误;
故选C.
点评 本题考查位置、结构与性质的综合应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素化合物及化学键,题目难度不大.

练习册系列答案
相关题目
13.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在这些元素中,原子半径最小的是K,原子半径最大的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?答:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2.
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在这些元素中,原子半径最小的是K,原子半径最大的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?答:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2.
14.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3molX和1molY在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
则CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3molX和1molY在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据上图和上表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
17.室温下,下列物质不与晶体硅反应的是( )
| A. | F2 | B. | HF | C. | KOH溶液 | D. | O2 |
14. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )
 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示. 关于该电池的叙述不正确的是( )| A. | 该电池不能在高温下工作 | |
| B. | 电池右侧电极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+通过质子交换膜向电池右侧迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成CO2 22.4 L(标况) |
1.有4.8g CuO、Fe2O3组成的混合物与充足的CO于加热条件下充分反应,得到m g固体,反应后全部气体用0.6mol•L-1 Ba(OH)2溶液100mL处理,有白色沉淀生成,又知反应后生成的气体质量为3.52g.下列有关说法正确的是( )
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
 .
.