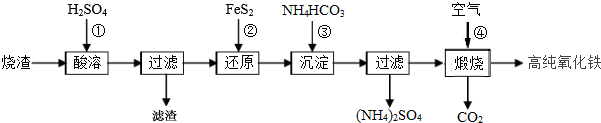
题目内容
13.如表是元素周期表的一部分,回答下列有关问题:| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在这些元素中,原子半径最小的是K,原子半径最大的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?答:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2.
分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体原子最外层为稳定结构,化学性质最不活泼的元素;
(3)氟元素没有最高价含氧酸,其它元素的最高价氧化物对应水化物中高氯酸的酸性最强;金属性越强,最高价氧化物对应水化物的碱性越强;氢氧化铝属于两性氢氧化物;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(5)金属性越强,化学性质越活泼,可以利用金属单质与水反应剧烈程度,生成强的碱性强弱比较.
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br,
故答案为:N;Si;S;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体原子最外层为稳定结构,最活泼的金属元素是K,最活泼的非金属元素是F,Ar的化学性质最不活泼,
故答案为:K;F;Ar;
(3)氟元素没有最高价含氧酸,其它元素的最高价氧化物对应水化物中酸性最强的是HClO4;K的金属性最强,故KOH的碱性最强,氢氧化铝与酸、碱分别反应均生成盐与水,属于两性氢氧化物;
故答案为:HClO4;KOH;Al(OH)3;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故K的原子半径最大,F的原子半径最小,
故答案为:K;F;
(5)Na的金属性比Mg的强,Na化学性质更活泼,可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2,
故答案为:Na;钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱 Mg(OH)2.
点评 本题考查元素周期表与元素周期律综合应用,熟练掌握元素周期表的结构,从结构上理解同主族、同周期元素性质的相似性,掌握金属性、非金属性强弱比较实验事实.

 阅读快车系列答案
阅读快车系列答案| A. | 用pH试纸测定溶液的酸碱性时,应先用蒸馏水将其润湿 | |
| B. | 利用焰色反应鉴定样品中是否含有K+时,应透过蓝色钴玻璃观察火焰的颜色 | |
| C. | 在中和滴定过程中,视线应始终注视滴定管内的液面变化 | |
| D. | 将溴水中的溴单质提取出来,应使用酒精作萃取剂 |
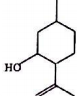
| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3mol 3mol | B. | 3mol 5mol | C. | 6 mol 10 mol | D. | 6 mol 8 mol |
| A. | 1-溴丁烷 | B. | 2-甲基-3-氯戊烷 | ||
| C. | 2,2-二甲基-1-氯丁烷 | D. | 一氯甲烷 |
| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为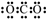 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的物质为离子化合物,既含有离子键又含有非极性键 |