题目内容
16.下列各式中不正确的是( )| A. | HF+H2O?H3O++F- | |
| B. | NaHCO3=Na++HCO3-,HCO3-?H++CO32- | |
| C. | Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| D. | S2-+2H2O?H2S+2OH- |
分析 A.氢氟酸为弱酸,水中部分电离;
B.碳酸氢钠属于强电解质,完全电离出钠离子和碳酸氢根离子,碳酸氢根离子部分电离出氢离子和碳酸根离子;
C.依据硫化银沉淀溶解可逆过程解答;
D.硫离子为多元弱酸根离子,分步水解.
解答 解:A..氢氟酸为弱酸,水中部分电离,电离方程式:HF+H2O?H3O++F-,故A正确;
B.碳酸氢钠属于强电解质,完全电离出钠离子和碳酸氢根离子,电离方程式:NaHCO3=Na++HCO3-,碳酸氢根离子部分电离出氢离子和碳酸根离子,电离方程式HCO3-?H++CO32-,故B正确;
C.硫化银为难溶物,溶于水存在沉淀容积平衡过程:Ag2S(s)?2Ag+(aq)+S2-(aq),故C正确;
D.硫离子为多元弱酸根离子,分步水解,离子方程式:S2-+H2O?HS-+OH-;HS-+H2O?H2S+OH-,故D错误;
故选:D.
点评 本题考查了离子方程式的书写、电解质电离方程式的书写、沉淀容积平衡方程式书写,明确电解质强弱、盐类水解规律、沉淀容解平衡是解题关键,题目难度不大.

练习册系列答案
相关题目
3.下列有关氧元素及其化合物的化学用语表示正确的是( )
| A. | 质子数为 8、中子数为 10 的氧原子:${\;}_{8}^{10}$O | |
| B. | 过氧化钠的电子式: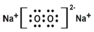 | |
| C. | 氧原子的电子排布图:1s22s22p4 | |
| D. | 次氯酸的结构式:H-Cl-O |
5.下列化学用语表示正确的是( )
| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: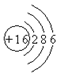 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
6.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属. 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题. 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)