题目内容
14.以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况)( )| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
分析 加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=$\frac{4.95g}{99g/mol}$=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2],阴极上析出n(H2)=n[Zn(OH)2],再根据V=nVm计算气体体积.
解答 解:加入4.95g Zn(OH)2时恰好能使溶液恢复到原浓度,Zn(OH)2从组成上可看成ZnO•H2O,所以电解过程中阴极上析出锌和氢气,4.95g Zn(OH)2固体的物质的量=$\frac{4.95g}{99g/mol}$=0.05mol,根据原子守恒知,阳极上析出n(O2)=n[Zn(OH)2]=0.05mol,阴极上析出n(H2)=n[Zn(OH)2]=0.05mol,生成气体体积V=nVm=(0.05+0.05)mol×22.4L/mol=2.24L,故选C.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,明确氢气、氧气与氢氧化锌关系式是解本题关键,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
4.下列离子方程式正确的是( )
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
5.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H5OH(l)反应生成C2H4(g)和H2O(l)的△H为( )
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
9.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. |  分离乙醇和水 | ||
| C. |  除去CO气体中的CO2 | D. |  除去粗盐中的不溶物 |
19.需要加入适当的氧化剂才能实现的变化是( )
| A. | PCl3→PCl5 | B. | HNO3→NO2 | C. | S→S2- | D. | SO3→H2SO4 |
6.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 以上三项均须要求的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 瓶塞不漏水的 |
3.${\;}_{92}^{235}U$是重要的工业原料,下列说法不正确的是( )
| A. | ${\;}_{92}^{235}U$原子核中含有92个质子 | B. | ${\;}_{92}^{235}U$原子核外有92个电子 | ||
| C. | ${\;}_{92}^{235}U$与${\;}_{92}^{238}U$互称为核素 | D. | ${\;}_{92}^{235}U$与${\;}_{92}^{238}U$中子数不同 |
4.下列关于铁制品腐蚀或保护措施的说法中不正确的有( )
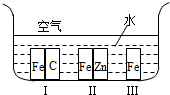

| A. | 在如图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ | |
| B. | 军事演习期间给坦克的履带上刷上油漆以防止生锈 | |
| C. | 在海轮的外壳上常焊有锌块,且定期更新 | |
| D. | 将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理 |