题目内容
4.下列离子方程式正确的是( )| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
分析 A.漏写生成氢氧化镁的离子反应;
B.反应生成硫酸钡、硫酸钠和水;
C.电子、电荷不守恒;
D.氢氧化钙完全电离,钙离子实际不参加反应.
解答 解:A.硫酸镁溶液跟氢氧化钡溶液反应的离子反应为Mg2++2OH-+SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故A错误;
B.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B正确;
C.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故C错误;
D.澄清石灰水中加入盐酸的离子反应为OH-+H+═H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 亚硫酸氢铵溶液中滴加少量NaOH溶液:NH4++OH-═NH3.H2O | |
| B. | 酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O═2I2+4OH- | |
| C. | 铜溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
12.据报道,2012年俄罗斯科学家再次合成117号元素.本次试验生成了6个新原子,其中5个${\;}_{117}^{293}$X,1个${\;}_{117}^{294}$X.下列关于${\;}_{117}^{293}$X和${\;}_{117}^{294}$X的说法,不正确的是( )
| A. | 是两种核素 | B. | 互为同素异形体 | ||
| C. | 中子数分别为176和177 | D. | 电子数相等 |
9.SO2和NOx都是大气污染物.
(1)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的过程SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4.
(2)表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
①雨后:二氧化硫能和水反应,所以雨后空气中的二氧化硫含量降低;
②风速较大时:风速越大,气体扩散速率越大,二氧化硫浓度也就越小.
(3)洗涤含SO2的烟气.以下物质不能作为洗涤剂的是cd(填字母序号).
a.熟石灰 b.纯碱 c.CaCl2d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
FeS2$→_{+O_{2}+H_{2}O}^{在微生物作用下}$Fe2++SO42-$→_{+O_{2}+H+}^{在微生物作用下}$Fe3+
①该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O$\underline{\underline{飘尘在微生物作用下}}$4H++2Fe2++4SO42-.
②处理1kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为74.7L(保留一位小数).
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示.由图1可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾.

(6)氧化-还原法消除NOx的转化如下:
NO$→_{反应I}^{O_{3}}$NO2$→_{反应II}^{CO(NH_{2})_{3}}$N2
①反应Ⅰ为NO+O3=NO2+O2,生成11.2L O2(标况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(7)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
(1)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的过程SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4.
(2)表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
| 平均风速(m/s) 天气情况 | 空气中SO2的平均含量(mg/L) |
| 雨前 | 0.03 |
| 雨后 | 0.01 |
| 晴 | 0.015 |
| 晴 | 0.03 |
②风速较大时:风速越大,气体扩散速率越大,二氧化硫浓度也就越小.
(3)洗涤含SO2的烟气.以下物质不能作为洗涤剂的是cd(填字母序号).
a.熟石灰 b.纯碱 c.CaCl2d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
FeS2$→_{+O_{2}+H_{2}O}^{在微生物作用下}$Fe2++SO42-$→_{+O_{2}+H+}^{在微生物作用下}$Fe3+
①该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O$\underline{\underline{飘尘在微生物作用下}}$4H++2Fe2++4SO42-.
②处理1kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为74.7L(保留一位小数).
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示.由图1可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾.

(6)氧化-还原法消除NOx的转化如下:
NO$→_{反应I}^{O_{3}}$NO2$→_{反应II}^{CO(NH_{2})_{3}}$N2
①反应Ⅰ为NO+O3=NO2+O2,生成11.2L O2(标况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(7)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、F- | |
| C. | pH=7的溶液中:K+、CO32-、SO42-、Cl- | |
| D. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ |
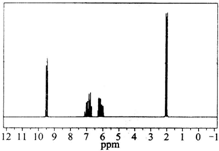 质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):