题目内容
19.需要加入适当的氧化剂才能实现的变化是( )| A. | PCl3→PCl5 | B. | HNO3→NO2 | C. | S→S2- | D. | SO3→H2SO4 |
分析 下列变化需要加入氧化剂才能实现,说明给予物质作作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中P元素化合价由+3价变为+5价,所以三氯化磷是还原剂需要氧化剂才能实现,如氯气,故A正确;
B.该反应中N元素化合价由+5价变为+4价,所以硝酸是氧化剂,需要还原剂才能实现,如铜等,故B错误;
C.该反应中S元素化合价由0价变为-2价,则S是氧化剂,需要还原剂才能实现,如氢气等,故C错误;
D.该反应中各元素化合价不变,不需要发生氧化还原反应才能实现,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重考查基本概念,明确化合价变化与氧化剂、还原剂关系是解本题关键,熟悉常见元素化合价.

练习册系列答案
相关题目
9.SO2和NOx都是大气污染物.
(1)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的过程SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4.
(2)表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
①雨后:二氧化硫能和水反应,所以雨后空气中的二氧化硫含量降低;
②风速较大时:风速越大,气体扩散速率越大,二氧化硫浓度也就越小.
(3)洗涤含SO2的烟气.以下物质不能作为洗涤剂的是cd(填字母序号).
a.熟石灰 b.纯碱 c.CaCl2d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
FeS2$→_{+O_{2}+H_{2}O}^{在微生物作用下}$Fe2++SO42-$→_{+O_{2}+H+}^{在微生物作用下}$Fe3+
①该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O$\underline{\underline{飘尘在微生物作用下}}$4H++2Fe2++4SO42-.
②处理1kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为74.7L(保留一位小数).
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示.由图1可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾.

(6)氧化-还原法消除NOx的转化如下:
NO$→_{反应I}^{O_{3}}$NO2$→_{反应II}^{CO(NH_{2})_{3}}$N2
①反应Ⅰ为NO+O3=NO2+O2,生成11.2L O2(标况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(7)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
(1)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的过程SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4.
(2)表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
| 平均风速(m/s) 天气情况 | 空气中SO2的平均含量(mg/L) |
| 雨前 | 0.03 |
| 雨后 | 0.01 |
| 晴 | 0.015 |
| 晴 | 0.03 |
②风速较大时:风速越大,气体扩散速率越大,二氧化硫浓度也就越小.
(3)洗涤含SO2的烟气.以下物质不能作为洗涤剂的是cd(填字母序号).
a.熟石灰 b.纯碱 c.CaCl2d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
FeS2$→_{+O_{2}+H_{2}O}^{在微生物作用下}$Fe2++SO42-$→_{+O_{2}+H+}^{在微生物作用下}$Fe3+
①该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O$\underline{\underline{飘尘在微生物作用下}}$4H++2Fe2++4SO42-.
②处理1kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为74.7L(保留一位小数).
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示.由图1可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾.

(6)氧化-还原法消除NOx的转化如下:
NO$→_{反应I}^{O_{3}}$NO2$→_{反应II}^{CO(NH_{2})_{3}}$N2
①反应Ⅰ为NO+O3=NO2+O2,生成11.2L O2(标况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(7)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
7.下列物质的分类合理的是( )
| A. | 电解质:CO2、Ca(OH)2、H2O、HNO3 | B. | 碱:NaOH、Ba(OH)2、Na2CO3、NH3•H2O | ||
| C. | 碱性氧化物:CaO、Na2O、FeO、Mn2O7 | D. | 盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO3 |
14.以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况)( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
9.2011年是国际化学年,中国的宣传口号是“化学--我们的生活,我们的未来”.下列有关叙述不正确的是( )
| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |


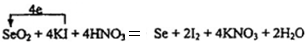 .
.