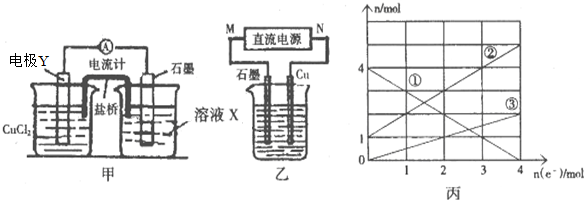
题目内容
1.计算下列溶液的pH值常温下0.0001 mol/L KOH溶液.
分析 常温下0.0001mol/LKOH溶液中c(OH-)=c(KOH)=0.0001mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,pH=-lgc(H+).
解答 解:常温下0.0001mol/LKOH溶液中c(OH-)=c(KOH)=0.0001mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,pH=-lgc(H+)=-lg10-10=10,
答:常温下0.0001mol/LKOH溶液的pH=10.
点评 本题考查溶液pH计算,为高频考点,明确pH值计算方法是解本题关键,注意酸碱混合溶液pH的计算方法.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
11.下列关于物质应用的说法中错误的是( )
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
12.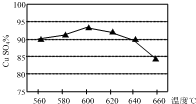 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.
 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.
9.已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表所示:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$
(3)根据反应①与②可推导出K1、K2与K3之间的关系式$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表中数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
| 温度 | 973K | 1173K |
| K1 | 1.47 | 2.15 |
| K2 | 2.33 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$
(3)根据反应①与②可推导出K1、K2与K3之间的关系式$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表中数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
6.下列各组物质中所含分子数相同的是( )
| A. | 10g CO和10g N2 | B. | 10g C2H4和10g C3H6 | ||
| C. | 5.6L O2(标准状况)和0.5mol H2O | D. | 224mL He(标准状况)和1.6g CH4 |
13.将标准状况下6.72L的氨气通入100mL 0.5mol•L-1氨水中,忽略溶液体积变化,所得溶液的物质的量浓度是( )
| A. | 3.0mol•L-1 | B. | 3.5mol•L-1 | C. | 4.0mol•L-1 | D. | 8.0mol•L-1 |
10.下列溶液中,PH>7的是( )
| A. | CH3COONa | B. | NaCl | C. | NH4Cl | D. | AlCl3 |