题目内容
16.氯化铁溶液能腐蚀铜,工业上常用此原理生产印刷线路板.(1)该反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)将上述反应设计成的原电池(如图甲所示,盐桥中装有含原胶的KCl饱和溶液).
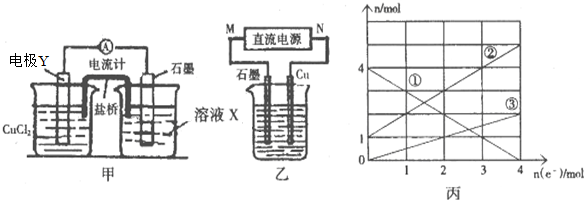
①图甲中电极是Cu(填电极材料名称),反应一段时间后图甲右边烧杯中溶液含有的金属阳离子有Fe3+、Fe2+(填离子符号);
②原电池工作时,盐桥中的Cl-(填离子符号)不断进入CuCl2溶液中.
(3)将上述应设计成电解池(如图乙所示),为节约药品取图甲工作一段时间后右边烧杯中的溶液为电解质溶液,图丙中的曲线①②③分别表示乙烧杯中某种金属阳离子的物质的量与电子转移的物质的量的变化关系.
①石墨电极上发生的电极反应式为Fe3++e-═Fe2+;
②图丙中的曲线③代表Cu2+(填离子符号)的变化.
③当电子转移为3mol时,需向乙烧杯中加入2L 7mol•L NaOH溶液才能使所有的金属离子沉淀完全.
分析 (1)铁离子与Cu反应生成亚铁离子和铜离子;
(2)原电池的构成条件:自发的氧化还原反应,据此确定电解质溶液,在原电池的负极上发生失电子的氧化反应,电解质中的阴离子移向负极,该反应为2Fe3++Cu═2Fe2++Cu2+,Cu做负极,石墨为正极,X为FeCl3溶液;
(3)根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
解答 解:(1)铁离子与Cu反应生成亚铁离子和铜离子,其反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+;
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)①该反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+,Cu做负极,发生的电极反应为Cu-2e-═Cu2+,石墨为正极,电极反应式为Fe3++e-=Fe2+,所以溶液中的离子有
Fe3+、Fe2+;
故答案为:Cu;Fe3+、Fe2+;
②阴离子向负极移动,所以Cl-不断进入CuCl2溶液中,
故答案为:Cl-;
(3)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,所以M为负极,N为正极,石墨上铁离子得电子生成亚铁离子,其电极反应为:Fe3++e-═Fe2+;
故答案为:Fe3++e-═Fe2+;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为Fe3+,②为Fe2+,③为Cu2+,故答案为:Cu2+;
③由图象可知,当电子转移为3mol时,溶液中有Fe3+ 1mol,Fe2+ 4mol,Cu2+为1.5mol,所以需要加入NaOH溶液1mol×3+4mol×2+1.5mol×2=14mol,所以NaOH溶液等体积为$\frac{14mol}{7mol/L}$=2L,
故答案为:2.
点评 本题考查了离子方程式的书写、原电池原理和电解原理的应用,题目综合性强,难度中等,主要考查学生分析问题的能力和计算能力,明确正负极以及阴阳极上发生的反应和电子守恒在计算中的应用方法是解题的关键.

| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 碱性:Na2CO3<NaHCO3 | ||
| C. | 水中的溶解度:Na2CO3<NaHCO3 | D. | 与盐酸反应速度Na2CO3>NaHCO3 |
| A. | 硫酸 硫酸镁 | B. | 碳酸 碳酸钠 | C. | 食盐 酒精 | D. | 碳酸钠 醋酸 |
| A. | 所有的盐都能水解 | B. | 所有的盐溶液都显酸性 | ||
| C. | 盐的水解都是吸热的 | D. | 盐的水解平衡是个静态平衡 |
