题目内容
实验室用锌根足量的稀硫酸反应制取氢气.若要制得0.25g氢气,需要锌的物质的量是多少?同时要消耗20%的硫酸(p=1.14g?cm3)多少毫升?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应Zn+H2SO4═ZnSO4+H2↑,根据方程式定比关系计算Zn的物质的量质量、消耗硫酸的质量,根据m=nM计算硫酸的质量,结合质量分数计算需要硫酸溶液的质量,再根据V=
计算硫酸溶液的体积.
| m |
| ρ |
解答:
解:设需要Zn的物质的量为x,消耗硫酸的质量为y,则:
Zn+H2SO4═ZnSO4+H2↑
1mol 98g 2g
x y 0.25g
1mol:x=2g:0.25g,解得:x=0.125mol
98g:2g=y:0.25g,解得:y=12.25g
则耗硫酸溶液的质量=12.25g÷20%,则消耗硫酸溶液的体积=(12.25g÷20%)÷1.14g/mL=53.7mL,
答:需要0.125mol锌,同时要消耗20%的硫酸53.7mL.
Zn+H2SO4═ZnSO4+H2↑
1mol 98g 2g
x y 0.25g
1mol:x=2g:0.25g,解得:x=0.125mol
98g:2g=y:0.25g,解得:y=12.25g
则耗硫酸溶液的质量=12.25g÷20%,则消耗硫酸溶液的体积=(12.25g÷20%)÷1.14g/mL=53.7mL,
答:需要0.125mol锌,同时要消耗20%的硫酸53.7mL.
点评:本题考查化学方程式的有关计算、溶液浓度计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
在0.1mol/L NH3?H2O 溶液中,下列关系正确的是( )
| A、c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+) |
| B、c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、c(NH3?H2O)>c(NH4+)=c(OH-)>c(H+) |
| D、c(NH3?H2O)>c(NH4+)>c(H+)>c(OH-) |
下列关于水的电离不正确的是( )
| A、加酸或碱一定抑制水的电离 |
| B、加盐一定促进水的电离 |
| C、升高温度,水的pH值变小 |
| D、常温下任何稀的酸、碱、盐水溶液中KW=10-14 |
下列说法不正确的是( )
| A、浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 |
| B、氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 |
| C、炭具有还原性,高温下能将二氧化硅还原为硅 |
| D、饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强 |
在一个固定容积的密闭容器中发生可逆反应:2A(g)+B(g)?3C(g)+D(s),不能说明达到平衡状态的标志是( )
| A、体系的压强不再改变 |
| B、混合气体密度不再改变 |
| C、反应速率3υA(正)=2υC(逆) |
| D、混合气体平均相对分子质量不再改变 |
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A、浓硫酸的体积增大 |
| B、用小刀切割金属钠时,发现切面由银白色变暗 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠的表面发生潮解 |
下列晶体性质的比较中,正确的是( )
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |

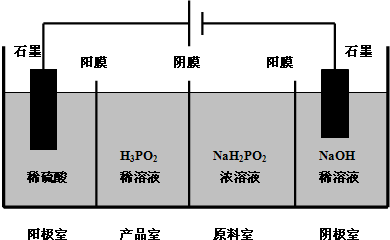 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题: