题目内容
17.某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.(1)写出甲中反应的化学方程式2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.

(2)为完成上述实验,正确的连接顺序为A接E,B接C(填接口字母).
(3)乙装置中X试剂可以是KI淀粉溶液,丙装置中Y试剂的作用是吸收氢气中的水.
将w g CuO置于硬质玻璃管中,按以下方案测得的数据计算Cu的相对原子质量.
| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
(5)下列情况将使测定结果偏大的是ac
a.CuO未完全还原为Cu b.CuO受潮
c.CuO中混有Cu d.碱石灰吸收了空气中的CO2和H2O
(6)如仍采用上述装置,请再设计一个方案,测定Cu的相对原子质量:将w g CuO置于硬质玻璃管中,分别称取反应前后硬质玻璃管和固体的质量.
分析 (1)电解氯化钠溶液生成氢氧化钠、氢气以及氯气,根据离子方程式的书写方法来回答;
(2)在电解池的阴极上产生的是氢气,阳极上产生的是氯气,据实验目的来连接装置;
(3)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;
(4)U型管+固体质量变化(b-a)为生成的水的质量,依据化学反应中质量变化计算铜的相对分子质量;
(5)结合计算式来分析判断,选项中个情况对测定结果产生的影响;
(6)可以利用硬质玻璃管在氢气还原氧化铜前后固体质量变化,结合化学方程式固体变化产生的差量计算.
解答 解:(1)电解饱和食盐水生成氢氧化钠、氯气、氢气,化学反应为2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,反应离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)A是阴极,阴极上产生的是氢气,B是阳极,阳极上产生的是氯气,要用氢气来还还原氧化铜,所以A连接E,干燥氢气后用氢气来还原氧化铜,所以B连接C,
故答案为:E;C;
(3)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝,乙装置中X试剂可以是KI淀粉溶液,丙装置中Y试剂的作用是吸收氢气中的水蒸气,
故答案为:KI淀粉溶液;吸收氢气中的水;
(4)U型管+固体质量变化(b-a)为生成的水的质量,结合化学方程式计算,设铜的相对原子质量为M
H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
M+16 18
wg (b-a)g
M=$\frac{18w-16b+16a}{b-a}$,
故答案为:$\frac{18w-16b+16a}{b-a}$;
(5)M=$\frac{18w-16b+16a}{b-a}$,
a.CuO未完全还原为Cu,计算式中b-a减小,则计算结果偏大,故a正确;
b.CuO受潮会导致b-a数值增大,计算结果偏小,故b错误;
c.CuO中混有Cu,w增大,计算式可知计算得到结果偏大,故c正确;
d.碱石灰吸收了空气中的CO2和H2O,会导致b-a数值增大,计算结果偏小,故d错误;
故答案为:ac;
(6)如仍采用上述装置,请再设计一个方案,测定Cu的相对原子质量,可以将w g CuO置于硬质玻璃管中,分别称取反应前后硬质玻璃管和固体的质量,依据化学反应前后固体变化计算得到,
故答案为:将w g CuO置于硬质玻璃管中,分别称取反应前后硬质玻璃管和固体的质量.
点评 本题考查了物质组成和性质的实验验证方法、实验基本操作、相对原子质量的测定和化学方程式差量计算等,掌握基础是解题关键,题目难度中等.

| A. | 硫酸、CuSO4•5H2O、苛性钾 | B. | 硫酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、食盐水、烧碱 |
| A. | 检验乙炔中是否混有H2S:湿润的醋酸铅试纸 | |
| B. | 盐酸滴定NaHCO3溶液:酚酞 | |
| C. | 检验淀粉是否完全水解:碘水 | |
| D. | 检验氯化氢是否集满:湿润的pH试纸 |
| A. | 甲苯的分子式为: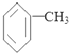 | |
| B. | 甲苯分子中所有原子都处于同一平面 | |
| C. | 甲苯的一氯取代物有5种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 甲苯和苯互为同系物 |
| 元素符号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与L形成的最高价氧化物对应水化物的碱性:L>M | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与等浓度的稀盐酸反应的速率为Q>L |
| A. | I2的量减少 | B. | 平衡逆向移动 | C. | ν(正)>ν(逆) | D. | HI转化率不变 |
 某同学设计了如下装置进行石油蒸馏的实验,回答下列有关问题:
某同学设计了如下装置进行石油蒸馏的实验,回答下列有关问题: