题目内容
X、Y、Z、W代表原子序数依次增大的四种短周期元素.在周期表中,X与Z相邻,Z与W相邻,X和Y可组成两种化合物Y2X、Y2X2,其焰色反应均为黄色.
(l)W的元素符号是 ;Z元素在周期表中的位置是第 周期 族.
(2)ZX2的晶体类型是 .
(3)写出Y2X2应用于潜艇中的化学方程式: ;
W单质与H2O反应的离子方程式: .
(4)WX2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过KWX3和H2C2O4在稀硫酸的环境中反应制得WX2.该反应的化学方程式为: .
(l)W的元素符号是
(2)ZX2的晶体类型是
(3)写出Y2X2应用于潜艇中的化学方程式:
W单质与H2O反应的离子方程式:
(4)WX2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过KWX3和H2C2O4在稀硫酸的环境中反应制得WX2.该反应的化学方程式为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X和Y可组成两种化合物Y2X、Y2X2,其焰色反应均为黄色,为Na的化合物,则为氧化钠和过氧化钠,原子序数X<Y,则X为O、Y为Na;
在周期表中,X与Z相邻,原子序数X<Z>Y,则Z为S元素;
Z与W相邻,原子序数Z<W,且为短周期元素,则W为Cl元素,
根据分析可知:X为O、Y为Na、Z为S元素、W为Cl元素,然后结合元素周期律知识解答.
在周期表中,X与Z相邻,原子序数X<Z>Y,则Z为S元素;
Z与W相邻,原子序数Z<W,且为短周期元素,则W为Cl元素,
根据分析可知:X为O、Y为Na、Z为S元素、W为Cl元素,然后结合元素周期律知识解答.
解答:
解:X和Y可组成两种化合物Y2X、Y2X2,其焰色反应均为黄色,为Na的化合物,则为氧化钠和过氧化钠,原子序数X<Y,则X为O、Y为Na;周期表中,X与Z相邻,原子序数X<Z>Y,则Z为S元素;Z与W相邻,原子序数Z<W,且为短周期元素,则W为Cl元素,
则:X为O、Y为Na、Z为S元素、W为Cl元素,
(1)根据分析可知,W为Cl元素;Z为S元素,S的原子序数为16,原子核外含有3个电子层、最外层含有6个电子,则S位于周期表中第三周期ⅥA族,
故答案为:Cl;三;ⅥA;
(2)ZX2为二氧化硫,属于共价化合物,二氧化硫分子之间通过范德华力形成二氧化硫晶体,其晶体属于分子晶体,
故答案为:分子晶体;
(3)Y2X2为Na2O2,Na2O2与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;
W的单质为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl+H2O=H++Cl-+HClO,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;Cl+H2O=H++Cl-+HClO;
(4)WX2为ClO2,KWX3为KClO3,KClO3在酸性条件下与H2C2O4发生氧化还原反应生成ClO2,反应的化学方程式为:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,
故答案为:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O.
则:X为O、Y为Na、Z为S元素、W为Cl元素,
(1)根据分析可知,W为Cl元素;Z为S元素,S的原子序数为16,原子核外含有3个电子层、最外层含有6个电子,则S位于周期表中第三周期ⅥA族,
故答案为:Cl;三;ⅥA;
(2)ZX2为二氧化硫,属于共价化合物,二氧化硫分子之间通过范德华力形成二氧化硫晶体,其晶体属于分子晶体,
故答案为:分子晶体;
(3)Y2X2为Na2O2,Na2O2与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;
W的单质为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl+H2O=H++Cl-+HClO,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;Cl+H2O=H++Cl-+HClO;
(4)WX2为ClO2,KWX3为KClO3,KClO3在酸性条件下与H2C2O4发生氧化还原反应生成ClO2,反应的化学方程式为:2KClO3+H2C2O4+H2SO4
| ||
故答案为:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O.
点评:本题考查了位置结构与性质的关系,题目难度中等,注意掌握原子结构与元素周期表、元素周期律的关系,正确推断各元素名称为解答关键,试题侧重基础知识的考查,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、某种液体的饱和蒸气压与温度有关 |
| B、物体内所有分子热运动动能的总和就是物体的内能 |
| C、气体的温度升高,每个分子的动能都增大 |
| D、不是所有晶体都具有各向异性的特点 |
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
下列离子方程式中书写正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
| C、澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
| D、稀盐酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 |
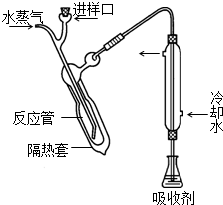 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
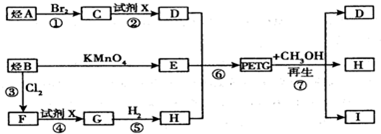 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)