题目内容
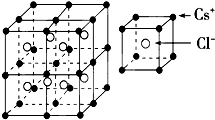 根据如图推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为
根据如图推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为考点:晶胞的计算
专题:化学键与晶体结构
分析:CsCl晶体中两距离最近的Cs+间距离为a,根据均摊法以及晶胞的立体模型判断每个离子的远近和数目即可解答.
解答:
解:以晶胞顶点Cs+为例,每个Cs+周围与其距离为a的Cs+数目为3×8×
=6个;
每个Cs+周围距离相等且次近的Cs+为面心上的Cs原子,数目为3×8×
=12,距离为
a;
距离相等且第三近的Cs+为体心上的,数目为1×8=8,距离为
a;
每个Cs+周围紧邻且等距的Cl-数目为1×8=8.
故答案为:6;12;
a;8;
a;8.
| 1 |
| 4 |
每个Cs+周围距离相等且次近的Cs+为面心上的Cs原子,数目为3×8×
| 1 |
| 2 |
| 2 |
距离相等且第三近的Cs+为体心上的,数目为1×8=8,距离为
| 3 |
每个Cs+周围紧邻且等距的Cl-数目为1×8=8.
故答案为:6;12;
| 2 |
| 3 |
点评:本题考查了晶胞的结构,侧重于考查晶胞结构的分析和计算,注意利用均摊法计算晶胞中各种原子个数,题目难度中等,解题关键是仔细观察晶胞结构图.

练习册系列答案
相关题目
在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A、v(A2)=0.8mol?L-1?s-1 |
| B、v(A2)=40mol?L-1?min-1 |
| C、v(AB3)=1.0mol?L-1?s-1 |
| D、v(B2)=1.2mol?L-1?s-1 |
下列实验操作,能有效改变反应速率且达到变化要求的是( )
| A、为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物 |
| B、为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液 |
| C、在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠 |
| D、用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸 |
下列图示与对应的叙述相符的是( )


| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v逆>v正 |
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾形成的种种美景的本质原因是( )
| A、空气中的小水滴颗粒直径大小约为1nm~100nm |
| B、光是一种胶体 |
| C、雾是一种胶体 |
| D、发生丁达尔效应 |
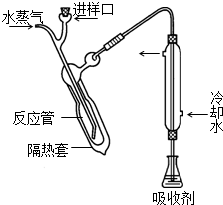 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下: