题目内容
18.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | J | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3 .
(3)在B、C、D、G中,原子半径由大到小顺序的是Na>Al>C>F.
分析 由元素在周期表中位置可知,A为H、B为Na、C为Al、D为C、J为Si,E为N、F为P、G为F、H为Cl、I为Ne;
(1)钠为活泼金属元素,利用焰色反应检验;
(2)上述元素的化合物中,NaOH的碱性最强,高氯酸的酸性最强,氢氧化铝具有两性;
(3)电子层越多,原子半径越大;同周期自左而右原子半径减小.
解答 解:由元素在周期表中位置可知,A为H、B为Na、C为Al、D为C、J为Si,E为N、F为P、G为F、H为Cl、I为Ne;
(1)实验室用焰色反应的方法检验B元素的存在,具体操作是洗净铂丝在酒精灯灼烧至无色,然后蘸取含B的物质或溶液,在酒精灯灼烧观察为黄色,
故答案为:焰色反应;洗净铂丝在酒精灯灼烧至无色,然后蘸取含B的物质或溶液,在酒精灯灼烧观察为黄色;
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3 ,故答案为:NaOH;HClO4;Al(OH)3 ;
(3)电子层越多,原子半径越大;同周期自左而右原子半径减小,则在B、C、D、G中,原子半径由大到小顺序的是Na>Al>C>F,故答案为:Na>Al>C>F.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.二氢月桂烯是一种香料中间体,其结构简式如图所示,下列有关二氢月桂烯的说法错误的是( )


| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
6.已知七种短周期元素a~g的有关信息如下表所示:
下列推断不正确的是( )
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
13.以惰性电极电解CuSO4溶液.一段时间后取出电极,加入0.1molCu(OH)2固体后溶液与电解前相同,则电解时电路中流过的电子为( )
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 | D. | 0.4 mol |
3.表是部分元素在周期表的位置,表中列有①~⑩中元素,用元素符号或化学式填空回答
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为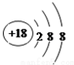
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
10.下列反应的离子方程式正确的是( )
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
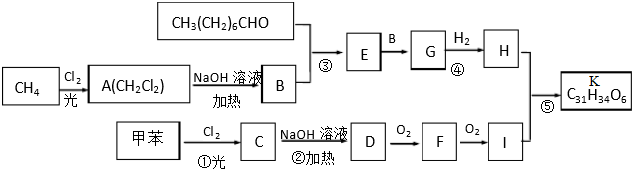
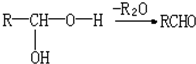
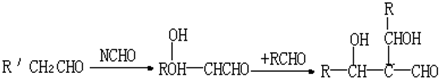
 .
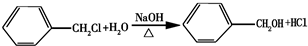
.
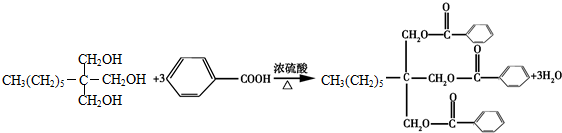
 .
.