题目内容
6.下列操作或装置中,不能达到实验目的是( )| A. | 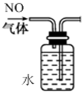 排水法收集NO | |
| B. | 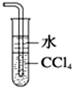 吸收尾气中少量NH3或HCl,并防止倒吸 | |
| C. |  制取并收集少量NH3 | |
| D. | 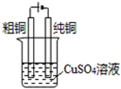 电解精炼铜 |
分析 A.NO不溶于水;
B.氨气或氯化氢易溶于水以及四氯化碳不溶于水且密度比水大;
C.加热氯化铵生成氨气与氯化氢,氯化氢与氨气遇冷又生成氯化铵,无法获得氨气;
D.粗铜与电源正极相连做电解池的阳极.
解答 解:A.NO不溶于水,可用排水法收集,故A正确;
B.氨气或氯化氢易溶于水而产生倒吸,但氨气或氯化氢不溶于四氯化碳,四氯化碳与水互不相溶且密度比水大,可起到防止倒吸的作用,故B正确;
C.氯化铵分解无法获得氨气,实验室用氢氧化钙和氯化铵制取氨气:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,故C错误;
D.电解精炼铜时,将粗铜与电源的正极相连,做电解池的阳极,失电子发生氧化反应,故D正确.
故选C.
点评 本题考查化学实验的评价,题目难度中等,侧重于学生的分析能力和实验能力的考查,注意相关物质的性质,把握实验方案的严密性和合理性的评价,易错点为A,注意气体的收集方法与气体的性质有关.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
16.下列数量的各物质中,含原子个数最多的是( )
| A. | 1molHCl | B. | 3.01×1023个O2 | C. | 12g12C | D. | 0.5molCH4 |
17.下列说法正确的是( )
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
1.在碱性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
11.在0.1mol•L-1的CH3COONa溶液中,下列关系不正确的是( )
| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 将CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的电离 | |
| D. | 等物质的量浓度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
18.I.甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇CO(g)+2H2(g)?CH3OH(g)
已知①常压下反应的能量变化如图1所示:
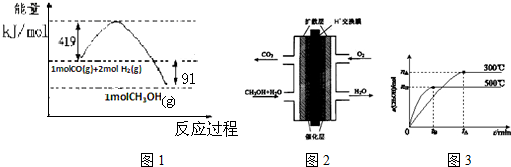
②有关键能的数据
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
已知①常压下反应的能量变化如图1所示:

②有关键能的数据
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
16.将金属A和金属B分别放入稀H2SO4中均有氢气生成.若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀;B未被腐蚀.关于B的叙述正确的是( )
| A. | 金属活动性B>A | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无气泡 |
 .
. .
.