题目内容
2.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Au2O、H2O.己知Na2S4O6是生成物之一.则下列说法正确的是( )| A. | 该反应体系中Au2O是氧化剂 | |
| B. | Na2S4O6是还原产物 | |
| C. | 该反应体系中起还原作用的元素是Au2O中+1价的Au | |
| D. | 该反应体系中每转移2mol电子则消耗1molH2O |
分析 己知Na2S4O6是生成物之一,则Na2S2O3为反应物,S元素的化合价升高,则Au元素的化合价降低,所以Au2O3为反应物,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH,结合氧化还原反应的有关概念分析.
解答 解:己知Na2S4O6是生成物之一,则Na2S2O3为反应物,S元素的化合价升高,则Au元素的化合价降低,所以Au2O3为反应物,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH,
A.反应中Au元素的化合价降低,则Au2O3为反应物,是氧化剂,故A错误;
B.Na2S2O3为反应物,S元素的化合价升高,被氧化,Na2S4O6是氧化产物,故B错误;
C.Au元素的化合价降低,Au2O3中Au起到氧化作用,故C错误;
D.根据方程式可知,1molAu2O3反应转移4mol电子,消耗2mol水,所以每转移2mol电子则消耗1molH2O,故D正确.
故选D.
点评 本题考查氧化还原反应知识,题目难度中等,解答本题的关键是根据题中信息结合化合价的变化判断反应物和生成物,侧重于考查学生的分析能力.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
10.实验室制备下列有机物时,试剂的加入顺序或加热方法中错误的是( )
| A. | 制乙烯:浓硫酸、乙醇,用酒精灯迅速加热至170℃ | |
| B. | 制硝基苯:浓硝酸、浓硫酸、苯,用55~60℃水浴加热 | |
| C. | 制乙酸乙酯:乙醇、浓硫酸、冰醋酸,用酒精灯缓慢加热 | |
| D. | 制酚醛树脂:苯酚、40%的甲醛溶液、浓盐酸,用沸水浴加热 |
17. 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
7.将9.58g Na2CO3•10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L.再取同质量的混合物,加入足量的盐酸,充分加热蒸干至质量不变时,所得固体的质量为( )
| A. | 5.85g | B. | 7.78g | C. | 6.72g | D. | 6g |
11.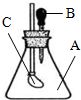 如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
 如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )| A. | A是Cl2,B是饱和NaCl溶液 | B. | A是NH3,B是酚酞溶液 | ||
| C. | A是H2,B是水 | D. | A是CO2,B是NaHCO3饱和溶液 |

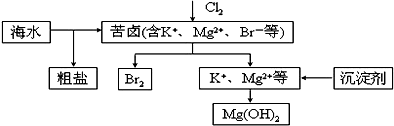 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.