题目内容
11.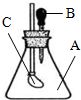 如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )| A. | A是Cl2,B是饱和NaCl溶液 | B. | A是NH3,B是酚酞溶液 | ||
| C. | A是H2,B是水 | D. | A是CO2,B是NaHCO3饱和溶液 |
分析 挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起,说明锥形瓶内压强减小,A可能溶于B或与B发生反应,以此来解答.
解答 解:挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起,说明锥形瓶内压强减小,A可能溶于B或与B发生反应,
A.食盐水抑制氯气的溶解,故A不选;
B.氨气易溶于水,故B选;
C.氢气不溶于水,故C不选;
D.二氧化碳不能溶于碳酸氢钠溶液,故D不选;
故选B.
点评 本题考查物质的性质及实验装置的应用,为高频考点,把握实验装置的作用、物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
12.下列关于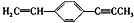 ,说法正确的是( )
,说法正确的是( )
 ,说法正确的是( )
,说法正确的是( )| A. | 最多只能有9个碳原子在同一平面上 | |
| B. | 有6个碳原子可能在同一直线上 | |
| C. | 最多有4个碳原子在同一直线上 | |
| D. | 所有原子一定都在同一平面上 |
2.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Au2O、H2O.己知Na2S4O6是生成物之一.则下列说法正确的是( )
| A. | 该反应体系中Au2O是氧化剂 | |
| B. | Na2S4O6是还原产物 | |
| C. | 该反应体系中起还原作用的元素是Au2O中+1价的Au | |
| D. | 该反应体系中每转移2mol电子则消耗1molH2O |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.4g镁原子变成离子时,失去的电子数为0.3NA | |
| B. | 22.4L甲烷(CH4)所含的原子数为5NA | |
| C. | 98 g H2SO4和98 g H3PO4所含的氧原子数都是4NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
6.能把K2SO4、(NH4)2SO4、NH4Cl、NaNO3四种溶液区别开来(可加热)的一种试剂是( )
| A. | BaCl2 | B. | NaOH | C. | Ba(NO3)2 | D. | Ba(OH)2 |
16.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 标准状况下,NA个CO2分子占有的体积为22.4 L |
3.下列说法正确的是( )
| A. | SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂 | |
| B. | 活性炭、H2O2、O3等都有漂白性 | |
| C. | 干燥的氯气和氯水都有漂白性 | |
| D. | Na2O2也有漂白性,其漂白原理和SO2相似 |
1.如图,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )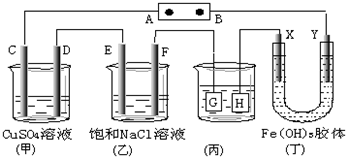

| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |