题目内容
13.下列说法正确的是( )| A. | 标准状况下,22.4LN2和O2的混合气体中所含分子总数为6.02×1023 | |
| B. | 常温常压下,等质量的O2和O3中所含的氧原子数均为6.02×1023 | |
| C. | 2L 0.5mol/LNa2SO4溶液中所含离子总数为6.02×1023 | |
| D. | H2O2催化分解生成0.5molO2时转移电子数目为1.204×1024 |
分析 A.标况下22.4L混合气体的物质的量为1mol;
B.氧气的质量不确定;
C.1molNa2SO4电离生成3mol离子;
D.H2O2催化分解生成0.5molO2时转移1mol电子.
解答 解:A.标况下22.4L混合气体的物质的量为1mol,所含的分子数为NA,故A正确;
B.氧气的质量不确定,无法计算氧原子数,故B错误;
C.2L 0.5mol/LNa2SO4溶液的物质的量是1mol.所含离子总数为3×6.02×1023,故C错误;
D.H2O2催化分解生成0.5molO2时转移1mol电子,数目为6.02×1023,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.对于某些离子的检验和结论正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |
4.能用铝槽车运输下列哪一种物质?( )
| A. | 盐酸 | B. | 氯水 | C. | 烧碱溶液 | D. | 浓硫酸 |
1.X、Y、Z、W为四种短周期元素,有关这四种元素的说法正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | X、Y、Z、W四种元素的单质均为分子晶体 | |
| B. | X、Y、Z、W四种元素的电负性:Y>X>W>Z | |
| C. | X与Z形成XZ2,其空间构型为直线型 | |
| D. | Y的氢化物与W的氢化物相互反应的产物只含有共价键 |
8.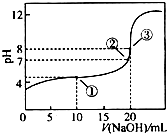 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )| A. | 该滴定过程可采用酚酞做指示剂 | |
| B. | 图中点③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| D. | 滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
18.下列说法中,不正确的是:①金属钠、氢气都能在氯气中燃烧,分别生成白色的烟和雾②铜丝在氯气中燃烧,生成蓝绿色的氯化铜③液氯就是氯气的水溶液,它能使干燥的有色布条褪色④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水( )
| A. | ②③ | B. | ①② | C. | ①④ | D. | ①②③④ |
5.将Na投入FeCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀,有气泡产生 | ||
| C. | 有铁生成 | D. | 无变化 |
3.下列关于氧化还原反应的说法中不正确的是( )
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |