题目内容
13.下列说法不正确的是( )| A. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| B. | 不慎将苯酚沾到皮肤上应立即用酒精清洗 | |
| C. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| D. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
分析 A.卤素原子能加速臭氧分解;
B.苯酚能溶于酒精;
C.高分子化合物的相对分子质量达到10000以上,油脂不是高分子化合物;
D.乙酸乙酯难溶于饱和碳酸钠,乙酸能与碳酸钠反应.
解答 解:A.氟氯烃在大气层中会释放出卤素原子,卤素原子能加速臭氧分解,则氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强,故A正确;
B.苯酚有毒,苯酚能溶于酒精,不慎将苯酚沾到皮肤上应立即用酒精清洗,故B正确;
C.淀粉、蛋白质属于天然高分子化合物,油脂不是高分子化合物,故C错误;
D.乙酸乙酯难溶于饱和碳酸钠,乙酸能与碳酸钠反应,则除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可,故D正确;
故选C.
点评 本题考查了环境污染及保护、有机物结构与性质,题目难度不大,明确常见有机物结构与性质为解答关键,注意掌握常见化学污染及治理方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
3.以废旧锂电池正极材料(含LiCoO2、Al、Cu、Fe等)为原料通过图1方法获得CoC2O4和Li2CO3.
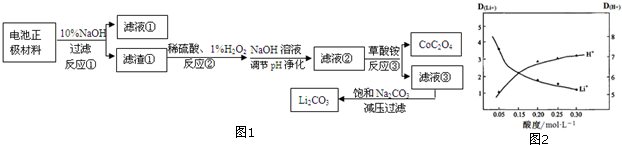
已知:ⅰ.LiCoO2是不溶于水的固体
ⅱ.25℃时,部分电解质的Ksp或Ka
回答下列问题:
(1)滤液①的主要成分是Na[Al(OH)4](填化学式,下同),滤液③中的阴离子除OH-外主要还含有C2O42-、SO42-.
(2)反应②中H2O2改用盐酸代替,不妥的原因是盐酸反应后会产生有毒气体Cl2同时盐酸不能氧化二价亚铁;写出反应②中钴元素化合物与H2O2反应的化学方程式2LiCoO2+3H2SO4+H2O2=2CoSO4+O2↑+Li2SO4+4H2O.
(3)减压过滤就是抽滤,抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是过滤速度快.
(4)若滤液②中c(Co2+)=3.0mol•L-1,加入等体积的(NH4)2C2O4后,钴的沉降率达到99.9%,计算滤液③中 c(C2O42-)=4.2×10-5mol•L-1.
(5)采用有机物萃取Li+的方法可提取锂.其中有机物中加入一定量Fe3+以提高萃取率,D为离子在有机层与水层的分配比.图2是其他条件不变,水相的酸度与D(H+)、D(Li+)的变化图象.解释萃取液酸度控制在0.05mol•L-1的原因可抑制萃取剂中Fe3+水解,同时此酸度时,Li+的萃取率较高.(写2点)
(6)在反应③中用草酸铵作沉淀剂,25℃时,(NH4)2C2O4溶液pH<7(填“=”或“>”或“<”).

已知:ⅰ.LiCoO2是不溶于水的固体
ⅱ.25℃时,部分电解质的Ksp或Ka
| 弱电解质 | CoC2O4 | Fe(OH)3 | NH3•H2O | H2C2O4 |
| 平衡常数 | Ksp=6.3×10-8 | Ksp=2.79×10-39 | Ka=1.7×10-5 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
(1)滤液①的主要成分是Na[Al(OH)4](填化学式,下同),滤液③中的阴离子除OH-外主要还含有C2O42-、SO42-.
(2)反应②中H2O2改用盐酸代替,不妥的原因是盐酸反应后会产生有毒气体Cl2同时盐酸不能氧化二价亚铁;写出反应②中钴元素化合物与H2O2反应的化学方程式2LiCoO2+3H2SO4+H2O2=2CoSO4+O2↑+Li2SO4+4H2O.
(3)减压过滤就是抽滤,抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是过滤速度快.
(4)若滤液②中c(Co2+)=3.0mol•L-1,加入等体积的(NH4)2C2O4后,钴的沉降率达到99.9%,计算滤液③中 c(C2O42-)=4.2×10-5mol•L-1.
(5)采用有机物萃取Li+的方法可提取锂.其中有机物中加入一定量Fe3+以提高萃取率,D为离子在有机层与水层的分配比.图2是其他条件不变,水相的酸度与D(H+)、D(Li+)的变化图象.解释萃取液酸度控制在0.05mol•L-1的原因可抑制萃取剂中Fe3+水解,同时此酸度时,Li+的萃取率较高.(写2点)
(6)在反应③中用草酸铵作沉淀剂,25℃时,(NH4)2C2O4溶液pH<7(填“=”或“>”或“<”).
4.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 密度:苯<水<溴苯 | B. | 沸点:戊烷>2-甲基丁烷>丙烷 | ||
| C. | 酸性:HCO3-< <H2CO3 <H2CO3 | D. | 与Na反应的速率:水>苯酚>乙醇 |
8.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论正确的是( )


| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |
8.根据表中7种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | ⑦①可形成离子化合物 |
9.下列说法正确的是( )
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
 ,CCH3CH3,D
,CCH3CH3,D .
.