题目内容
7.用下列方法均可制得氧气:①2KClO3═2KCl+3O2↑;②2Na2O2+2H2O=4NaOH+O2↑
③2HgO═2Hg+O2↑;④2KMnO4═K2MnO4+MnO2+O2↑,
若要制得相同质量的氧气,反应中电子转移数目之比为2:1:2:2.
分析 制得相同质量的氧气,可假设得到3molO2,
则:①2KClO3=2KCl+3O2↑~12e-,
3 12
②2Na2O2+2H2O═4NaOH+O2↑~2e-,
3 6
③2HgO=2Hg+O2↑~4e-,
3 12
2KMnO4=K2MnO4+MnO2+O2↑~4e-,
3 12
据此进行计算制得相同质量的氧气,反应中电子转移数目之比.
解答 解:制得相同质量的氧气,可假设得到3molO2,则
①2KClO3=2KCl+3O2↑~12e-,
3 12
②2Na2O2+2H2O═4NaOH+O2↑~2e-,
3 6
③2HgO=2Hg+O2↑~4e-,
3 12
2KMnO4=K2MnO4+MnO2+O2↑~4e-,
3 12
所以制得相同质量的氧气,反应中电子转移数目之比为12:6:12:12=2:1:2:2,
故答案为:2:1:2:2.
点评 本题考查氧化还原反应的计算,为高频考点,题目难度中等,侧重氧化还原反应电子转移的考查,注意电子守恒的应用,明确反应中元素的化合价变化即可解答.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
17.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
18.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化铝与过量氨水反应 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量CO2通入氢氧化钡的稀溶液中 CO2+OH-═HCO3- |
4.下列关于胶体的说法正确的是( )
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |

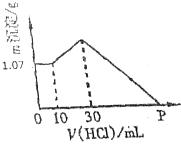 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤: