题目内容
10.25℃时,将0.40mol.L-1HCN溶液与0.20mol.L-1NaOH溶液各100mL混合后,测得溶液的pH=a(a>7).则该溶液中所有离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+),c(HCN)-c(CN-)=2[10 a-14-10-a]mol.L-1(假设混合后体积等于两种溶液体积之和)分析 25℃时,将0.40mol.L-1HCN溶液与0.20mol.L-1NaOH溶液各100mL混合后,混合溶液中溶质为等物质的量浓度的HCN和NaCN,测得溶液的pH=a(a>7),溶液呈碱性,说明NaCN水解程度大于HCN,结合电荷守恒判断离子浓度大小;
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CN-)、根据物料守恒得2c(Na+)=c(HCN)+c(CN-),所以得c(HCN)+2c(H+)=2c(OH-)+c(CN-),则c(HCN)-c(CN-)=2c(OH-)-2c(H+).
解答 解:25℃时,将0.40mol.L-1HCN溶液与0.20mol.L-1NaOH溶液各100mL混合后,混合溶液中溶质为等物质的量浓度的HCN和NaCN,测得溶液的pH=a(a>7),溶液呈碱性,则c(H+)<c(OH-),说明NaCN水解程度大于HCN,结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)得c(Na+)>c(CN-),盐类水解较微弱,所以离子浓度大小顺序是c(Na+)>c(CN-)>c(OH-)>c(H+);
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CN-)、根据物料守恒得2c(Na+)=c(HCN)+c(CN-),所以得c(HCN)+2c(H+)=2c(OH-)+c(CN-),则c(HCN)-c(CN-)=2c(OH-)-2c(H+)=2[10 a-14-10-a]mol/L,
故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);2[10 a-14-10-a].
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确各个物理量之间关系是解本题关键,注意电荷守恒、物料守恒的灵活运用,注意该混合溶液中HCN电离程度小于CN-水解程度.

| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
| A. | 向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化铝与过量氨水反应 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量CO2通入氢氧化钡的稀溶液中 CO2+OH-═HCO3- |
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |

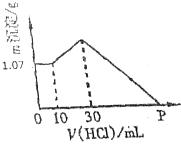 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求