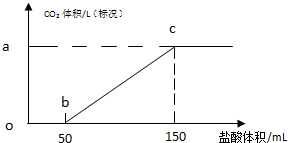
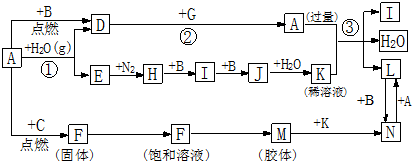
题目内容
9.(1)光导纤维的主要成分是SiO2(填化学式).碱性溶液不能用带玻璃塞的试剂瓶盛装的原因是(用离子方程式说明)SiO2+2OH-=SO32-+H2O.(2)漂白粉的有效成分是次氯酸钙(填物质名称),其漂白原理是(用化学方程式表示)Ca(ClO)2+H2O+CO2=CaCO3↓+2HClOCa(ClO)2+H2O+CO2=CaCO3↓+2HClO.
分析 (1)光导纤维的成分为二氧化硅,二氧化硅与NaOH反应生成具有粘合性的硅酸钠,则碱性溶液不能用带玻璃塞的试剂瓶盛装,以此来解答;
(2)漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,次氯酸的酸性比碳酸弱.
解答 解:(1)光导纤维的主要成分是SiO2.碱性溶液不能用带玻璃塞的试剂瓶盛装的原因是SiO2+2OH-=SO32-+H2O,故答案为:SiO2;SiO2+2OH-=SO32-+H2O;
(2)漂白粉的有效成分是次氯酸钙,由于次氯酸的酸性比碳酸弱,次氯酸钙能与二氧化碳和水反应生成具有漂白性的次氯酸,反应为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,故答案为:次氯酸钙;Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
9.为了检验某固体物质中是否含有NH4+,你认为下列试纸和试剂用到的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
20.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=12的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Al3+的溶液中:Na+、Cl-、AlO2-、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
4.下列实验操作、现象或结论正确的是( )
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 | |
| D. | 加入盐酸,放出无色气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中有CO32- |
18.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用食醋检验牙膏中的摩擦剂碳酸钙:CaCO+2H+═Ca2++H2O+CO2↑ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O═Cl-+SO42-+2H+ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
19.下列化学实验事实及其解释都正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气分子能漂白有机分子 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀,说明溶液中有SO42- |