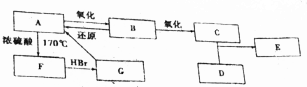
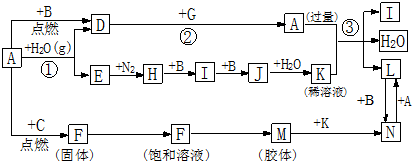
题目内容
1.硫及其化合物在工农业生产中有着重要的应用.(1)某实验小组在实验窒用BaSO4、炭混合,在高温煅烧制备BaS,查表得:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H1=+571.2 kJ?mol-1①
BaSO4(s)+2C(s)=BaS(s)+2CO2(g)△H2=+226.2 kJ?mol-1②
则反应C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)的△H3=+172.5kJ?mol-1
实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为0.4mol.
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).

①含硫物种B表示HS-.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为c(填字母).
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+(用离子方程式表示).
(4)在高温下,H2S可完全分解为硫单质Sn(g)和H2,实验测得分解产物中H2与Sn(g)物质的量之比4:1,则n的值为4,写出其分解反应方程式为4H2S=4H2+S4(g).
分析 (1)根据所给的热化学方程式,结合要求的反应,利用盖斯定律来分析计算;加入过量C可提高重晶石的转化率,同时维持反应进行;
(2)As2S3+10H++10NO3-═2H3AsO4+3S+10NO2↑+2H2O中,As元素的化合价由+3价升高为+5价,S元素的化合价由-2价升高为0,N元素的化合价由+5价降低为+4,以此来解答;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系;
②NaHS溶液中加入CuSO4溶液,会发生反应生成硫化铜和酸;
(4)在高温下,H2S可完全分解为硫单质Sn(g)和H2,实验测得分解产物中H2与Sn(g),反应方程式为:nH2S=nH2+Sn(g),物质的量之比4:1,所以n=4,所以反应方程式为:4H2S=4H2+S4(g).
解答 解:(1)利用盖斯定律求解:
BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H3=$\frac{571.2LJ/mol-226.2KJ/mol}{2}$=+172.5kJ•mol-1,加入过量C可提高重晶石的转化率,以上反应为吸热反应,炭和氧气反应放热维持反应所需高温,
故答案为:+172.5;使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温;
(2)由反应可知,As元素的化合价由+3价升高为+5价,S元素的化合价由-2价升高为0,生成2molH3AsO4时.转移电子10mol,
则当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为0.4mol,
故答案为:0.4 mol;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故答案为:HS-;c;
②NaHS溶液中加入CuSO4溶液,会发生反应Cu2++HS-=CuS↓+H+,溶液显示强酸性,故答案为:Cu2++HS-=CuS↓+H+;
(4)在高温下,H2S可完全分解为硫单质Sn(g)和H2,实验测得分解产物中H2与Sn(g),反应方程式为:nH2S=nH2+Sn(g),物质的量之比4:1,所以n=4,所以反应方程式为:4H2S=4H2+S4(g),故答案为:4;4H2S=4H2+S4(g).
点评 本题涉及盖斯定律的应用、氧化还原反应以及溶液中离子浓度之间的关系等知识的考查,综合性强,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
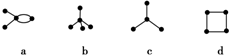
| A. | a和d互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能发生加成反应 | D. | b、c、d都能发生取代反应 |
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=12的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Al3+的溶液中:Na+、Cl-、AlO2-、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
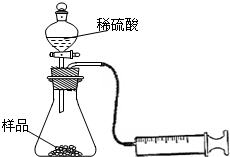 某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: