题目内容
5.白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性FeO4胶体粒子及副产物ZnO.制备流程如下: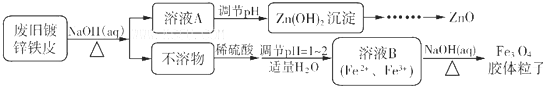
已知:Zn及其化合物的性质与Al及其化合物的性质相似.请回答下列问题:
(l)用NaOH溶液处理废旧镀锌铁皮的作用是ab.
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用c检验其是否存在.
a.NaOH溶液 b.KSCN溶液 C.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入以保证产品的纯度,其原因
是N2气氛下,防止Fe2+被氧化.
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过
程为:Fe2++S2O${\;}_{3}^{2-}$+O2+OH-→Fe3O4(胶体)+S4O${\;}_{6}^{2-}$+H2O
①反应过程中起还原剂作用的微粒是Fe2+、S2O32-;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况 下的体积为22.4L.
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到溶液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子,据此分析作答.
解答 解:(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
故答案为:ab;
(2)Fe2+有还原性,可被高锰酸钾溶液氧化,使高锰酸钾褪色,故可选高锰酸钾检验;
故答案为:c;
(3)持续通入N2,防止Fe2+被氧化;
故答案为:N2气氛下,防止Fe2+被氧化;
(4)①根据反应Fe2++S2O32-+O2+OH-→Fe3O4(胶体)+S4O62-+H2O,其中部分亚铁化合价升高,硫元素化合价升高,被氧化,作还原剂;
故答案为:Fe2+、S2O32-;
②配平方程:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气为1mol,则标准状况下的体积为22.4L;
故答案为:22.4.
点评 本题以物质制备为载体,考查实验基本操作和技能,涉及对信息的利用、实验条件的控制、氧化还原反应的计算等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.

练习册系列答案
相关题目
2.下列对化学用语的理解正确的是( )
| A. | 离子结构示意图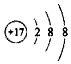 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式 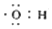 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式为: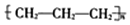 |
19.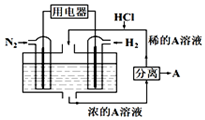 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
6.香叶醛(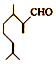 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水发生加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
10.在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H<0,反应过程中测定的数据如表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 反应前2 min的平均速率v(C)=0.004 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol | |
| D. | 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大 |
17.常温下,下列有关电解质溶液的叙述正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7 | |
| C. | pH为a的CH3COOH溶液和pH为b的NaOH溶液混合后溶液显酸性,则a一定大于b | |
| D. | 将10mLpH=a的盐酸与100 mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
15.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |