题目内容
19.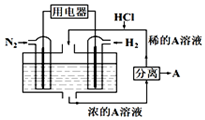 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
分析 以N2、H2为原料,以溶有A的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,以此解答该题.
解答 解:A.氮气被还原生成NH4+,所以通入N2的一极为正极,故A错误;
B.负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,故B错误;
C.根据负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,则H2为负极,A为NH4Cl,故C正确;
D.反应过程中左边区域溶液氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,pH逐渐增大,故D错误.
故选C.
点评 本题考新型燃料电池,为高频考点,侧重于学生的分析能力的考查,注意正负极的反应,从化合价变化的角度分析,难度不大.

练习册系列答案
相关题目
9.将10mL充满NO2和O2混合气体的试管倒立在水槽中,反应停止后试管剩余2mL无色气体,原混合气体中NO2和O2各是多少毫升( )
| A. | 8.2mL和1.8mL | B. | 5.6mL和4.4mL | C. | 6.4mL和3.6mL | D. | 3.5mL和6.5mL |
10.下列说法正确的是( )
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | H2O和H2O2互为同素异形体 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 同种元素的原子中,中子数和质子数一定都相同 |
7.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | 简单离子半径:W>X | |
| B. | 含氧酸的酸性:W>Z | |
| C. | 气态氢化物的稳定性:W<Y | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
14.下列有机反应:①甲烷与氯气光照反应 ②乙醛制乙酸 ③乙烯使溴水褪色 ④乙醇制乙烯 ⑤乙醛制乙醇 ⑥乙酸制乙酸乙酯 ⑦乙酸乙酯与NaOH溶液共热 ⑧液态植物油制人造脂肪 ⑨乙烯制乙醇的说法正确的是( )
| A. | ②⑤的反应类型相同 | B. | ⑥⑦的反应类型不同 | ||
| C. | ④与其他8个反应的类型都不同 | D. | ①③⑧属于同一种反应类型 |
4.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
3.常温下,在某密闭容器中充入a摩尔H2S和b摩尔SO2,测得反应后溶器内压强为反应前的一半,则a:b为( )
| A. | 1:2 | B. | 2:3 | C. | 4:5 | D. | 5:1 |

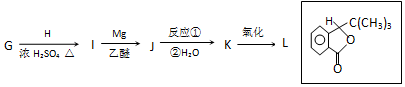
 ;F的结构简式为
;F的结构简式为 .
.
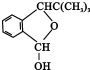 .
.