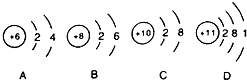
题目内容
10.下列关于“化学与健康”的说法正确的是( )| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性 | |
| C. | 采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
分析 A.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子;
B.CxHy、CO等具有还原性,H2O2具有强氧化性;
C.采用的新型氢动力计程车可减少固体颗粒物的排放;
D.铁粉不能吸收水,可作抗氧化剂.
解答 解:A.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故A错误;
B.CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故B错误;
C.采用的新型氢动力计程车可减少固体颗粒物的排放,则可以降低PM2.5的排放,减小大气污染,故C正确;
D.铁粉不能吸收水,可作抗氧化剂,而生石灰、硅胶是食品包装中常用的干燥剂,故D错误;
故选C.
点评 本题考查物质的性质、应用等,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,综合性较强,注意化学与生活的联系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③混合,若溶液pH=7,则体积V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,各离子浓度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
18.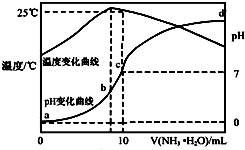 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
5.葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6$\stackrel{酵母}{→}$2CH3CH2OH+2CO2↑).

Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略如图1).
实验操作和现象:
(1)溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略如图2)
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.
由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图3所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp=1×10-10,Ksp=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全,此时溶液中c(SO32-)≤0.05mol•L-1.

Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略如图1).
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略如图2)
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.
由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图3所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp=1×10-10,Ksp=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全,此时溶液中c(SO32-)≤0.05mol•L-1.
2.为提纯如表物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| B | 乙酸乙酯(乙酸) | KOH溶液.水 | 分液 |
| C | CO2(CO) | CuO粉末 | 通过灼热的CuO粉末 |
| D | SiO2(Al2O3) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
19.NA为阿伏加德罗常数,下述正确的是( )
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | 标准状况下,22.4L的水含有 NA个水分子 |
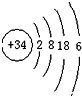 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;