题目内容
2.为提纯如表物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| B | 乙酸乙酯(乙酸) | KOH溶液.水 | 分液 |
| C | CO2(CO) | CuO粉末 | 通过灼热的CuO粉末 |
| D | SiO2(Al2O3) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者均与NaOH反应;
B.二者均与KOH反应;
C.CO还原CuO生成二氧化碳;
D.二者均与NaOH溶液反应.
解答 解:A.二者均与NaOH溶液反应,应选氨水、反应后过滤,故A错误;
B.二者均与KOH反应,不能除杂,应选饱和碳酸钠溶液、分液,故B错误;
C.CO还原CuO生成二氧化碳,则通过灼热的CuO粉末可除杂,故C正确;
D.二者均与NaOH溶液反应,不能除杂,应选盐酸、过滤,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意元素化合物知识的应用.

练习册系列答案
相关题目
12.亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.
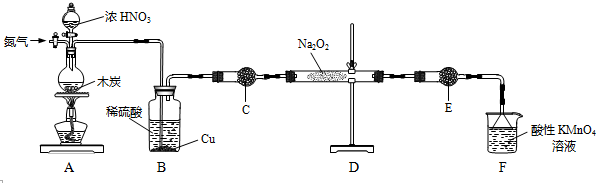
已知:①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③5NO${\;}_{2}^{-}$+2MnO${\;}_{4}^{-}$+6H+→NO${\;}_{3}^{-}$+2Mn2++3H2O
④NO和Na2O2都能使酸性高锰酸钾溶液褪色.
⑤实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶、过滤可得CuSO4•5H2O.
(1)装置A中发生反应的化学方程式为C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)反应前检验装置气密性的操作为关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降,加热装置A前,先通一段时间N2,目的是排除装置内的空气.
(3)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸(或稀盐酸),试管内有气泡产生且在试管上方产生红棕色气体,则产物是NaNO2(注明试剂、现象).
(4)为测定产物中亚硝酸钠的含量,称取4.000g产物样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
第一组实验数据出现异常,造成这种异常的原因可能是BD(填字母),
A.锥形瓶洗净后未干燥 B.滴定管用蒸馏水洗净后未用标准液润洗
C.振荡时有液体溅出来 D.锥形瓶用蒸馏水洗净后再用待测液润洗
(5)根据表中数据,计算出产物中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO${\;}_{2}^{-}$的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度.

已知:①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③5NO${\;}_{2}^{-}$+2MnO${\;}_{4}^{-}$+6H+→NO${\;}_{3}^{-}$+2Mn2++3H2O
④NO和Na2O2都能使酸性高锰酸钾溶液褪色.
⑤实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶、过滤可得CuSO4•5H2O.
(1)装置A中发生反应的化学方程式为C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)反应前检验装置气密性的操作为关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降,加热装置A前,先通一段时间N2,目的是排除装置内的空气.
(3)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸(或稀盐酸),试管内有气泡产生且在试管上方产生红棕色气体,则产物是NaNO2(注明试剂、现象).
(4)为测定产物中亚硝酸钠的含量,称取4.000g产物样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.锥形瓶洗净后未干燥 B.滴定管用蒸馏水洗净后未用标准液润洗
C.振荡时有液体溅出来 D.锥形瓶用蒸馏水洗净后再用待测液润洗
(5)根据表中数据,计算出产物中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO${\;}_{2}^{-}$的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度.
10.下列关于“化学与健康”的说法正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性 | |
| C. | 采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
17.X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是( )
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
7.ωg铁粉和铝粉的混合物,与过量的NaOH溶液反应,然后过滤,将沉淀放在蒸发皿中加热,充分反应后,所得固体物质的质量仍为ωg.则原混合物中铝粉的质量分数是( )
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
1.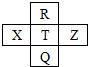 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
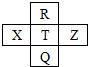 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:Z<X<T | ||
| C. | 最高价氧化物的水化物酸性:Q<T<R | D. | 气态氢化物的还原性:R<T<X |
 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.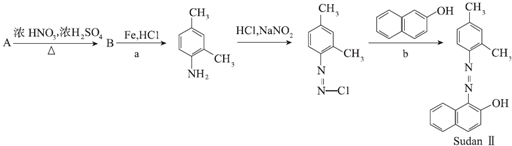
 .
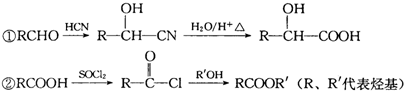
.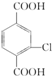 +4NaOH→
+4NaOH→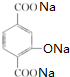 +NaCl+3H2O.②E→F
+NaCl+3H2O.②E→F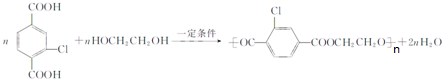 .
.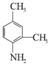 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.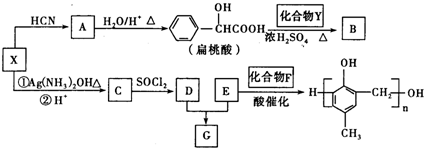
 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +
+ .
. 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 .
.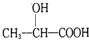 )的路线(其它试剂任选).
)的路线(其它试剂任选). B…$→_{反应条件}^{反应试剂}$目标产物)
B…$→_{反应条件}^{反应试剂}$目标产物)