题目内容
在体积恒定的密闭容器中投入物质A和物质B在适宜的条件下发生反应:A(s)+2B(g)?2C(g)+D(g)
(1)下列能表示反应已达平衡状态的是
A.2v(B)正=v(D)逆
B.混合气体的密度保持不变
C.混合气体中B,C,D的浓度之比为2:2:1
D.混合气体的压强不随时间变化而变化
(2)相同的压强下,充入一定量的A,B后,在不同温度下C的百分含量与时间的关系如图2所示.则T1 T2(填“>”“<”或“=”),该反应的正反应的△H 0(填“>”“<”或“=”).
(3)若该反应的逆反应速率与时间的关系如图所示:
①可见反应在t1,t3,t7时都达到了平衡,而t2,t8时都改变了条件,则t8时改变的条件是 .
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图3中画出t4-t6时逆反应速率与时间的关系线.
(4)物质B在一定波长的光照射下发生分解反应,B的浓度随反应时间变化如图所示,计算反应4-8min间的平均速率 ,推测反应进行到16min时B的浓度为 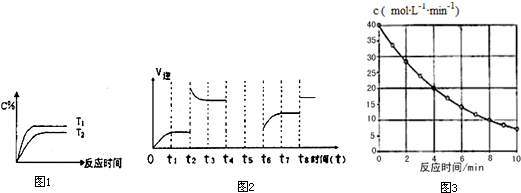
(1)下列能表示反应已达平衡状态的是
A.2v(B)正=v(D)逆
B.混合气体的密度保持不变
C.混合气体中B,C,D的浓度之比为2:2:1
D.混合气体的压强不随时间变化而变化
(2)相同的压强下,充入一定量的A,B后,在不同温度下C的百分含量与时间的关系如图2所示.则T1
(3)若该反应的逆反应速率与时间的关系如图所示:
①可见反应在t1,t3,t7时都达到了平衡,而t2,t8时都改变了条件,则t8时改变的条件是
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图3中画出t4-t6时逆反应速率与时间的关系线.
(4)物质B在一定波长的光照射下发生分解反应,B的浓度随反应时间变化如图所示,计算反应4-8min间的平均速率

考点:化学平衡状态的判断,体积百分含量随温度、压强变化曲线,化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:(1)当正逆反应速率相等,各组分浓度保持不变时,反应达到平衡状态;
(2)根据先拐先平衡,如图1T1>T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应;
(3)①t8后,正逆反应速率同等程度增大,反应前后气体体积不相同,只能是使用了催化剂;
②根据速率图象分析,根据t4时降压,平衡正向移动,t5时达到平衡,t6时增大反应物的浓度,平衡正向移动,分析绘制图象;
(4)根据v=
计算反应4~8min间的平均反应速率;
0~4 min期间,反应物浓度变化为(40-20)mol/L=20mol/L,4~8 min期间,反应物浓度变化为(20-10)mol/L=10μmol/L,可知,每隔4分钟,速率降为原来的一半,据此计算.
(2)根据先拐先平衡,如图1T1>T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应;
(3)①t8后,正逆反应速率同等程度增大,反应前后气体体积不相同,只能是使用了催化剂;
②根据速率图象分析,根据t4时降压,平衡正向移动,t5时达到平衡,t6时增大反应物的浓度,平衡正向移动,分析绘制图象;
(4)根据v=
| △c |
| △t |
0~4 min期间,反应物浓度变化为(40-20)mol/L=20mol/L,4~8 min期间,反应物浓度变化为(20-10)mol/L=10μmol/L,可知,每隔4分钟,速率降为原来的一半,据此计算.
解答:
解:(1)B与D的速率之比应为2:1,不是1:2,故A错误;
B、A为固体,反应正向进行时气体质量增大,密度增大,所以密度不变时反应达到平衡状态,故B正确;
C、平衡时各物质浓度之比的大小,决定于开始加入的多少,与是否达到平衡状态无关,故C错误;
D、反应前后气体体积不相同,所以压强不变说明反应达到平衡状态,故D正确;
故答案为:BD;
(2)根据先拐先平衡,如图1T1>T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应,故答案为:>;>;
(3)①t8后,正逆反应速率同等程度增大,反应前后气体体积不相同,只能是使用了催化剂,故答案为:使用催化剂;
②t4时降压,则逆反应速率瞬间变小后逐渐增大,平衡正向移动,t5时达到平衡逆反应速率不变,t6时增大反应物的浓度,逆反应瞬间没变,但随后速率也会慢慢增加,所以请在图2中画出t4~t6时逆反应速率与时间的关系线如图: ,
,
故答案为: ;
;
(4)由图可知,4~8 min期间,反应物浓度变化为(20-10)mol/L=10mol/L,
所以4~8 min期间,反应速率为
=2.5 mol/(L?min);
由图可知,0~4 min期间,反应物浓度变化为(40-20)mol/L=20mol/L,4~8 min期间,反应物浓度变化为(20-10)mol/L=10mol/L,可知,每隔4分钟,浓度变化量降为原来的一半,所以8~12min浓度变化为5 mol/L,12~16min浓度变化为2.5 mol/L,
所以16min时浓度为10 mol/L-5 mol/L-2.5 mol/L=2.5 mol/L,故答案为:2.5 mol/(L?min);2.5 mol/L.
B、A为固体,反应正向进行时气体质量增大,密度增大,所以密度不变时反应达到平衡状态,故B正确;
C、平衡时各物质浓度之比的大小,决定于开始加入的多少,与是否达到平衡状态无关,故C错误;
D、反应前后气体体积不相同,所以压强不变说明反应达到平衡状态,故D正确;
故答案为:BD;
(2)根据先拐先平衡,如图1T1>T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应,故答案为:>;>;
(3)①t8后,正逆反应速率同等程度增大,反应前后气体体积不相同,只能是使用了催化剂,故答案为:使用催化剂;
②t4时降压,则逆反应速率瞬间变小后逐渐增大,平衡正向移动,t5时达到平衡逆反应速率不变,t6时增大反应物的浓度,逆反应瞬间没变,但随后速率也会慢慢增加,所以请在图2中画出t4~t6时逆反应速率与时间的关系线如图:
 ,
,故答案为:
 ;
;(4)由图可知,4~8 min期间,反应物浓度变化为(20-10)mol/L=10mol/L,
所以4~8 min期间,反应速率为
| 10mol/L |
| 4min |
由图可知,0~4 min期间,反应物浓度变化为(40-20)mol/L=20mol/L,4~8 min期间,反应物浓度变化为(20-10)mol/L=10mol/L,可知,每隔4分钟,浓度变化量降为原来的一半,所以8~12min浓度变化为5 mol/L,12~16min浓度变化为2.5 mol/L,
所以16min时浓度为10 mol/L-5 mol/L-2.5 mol/L=2.5 mol/L,故答案为:2.5 mol/(L?min);2.5 mol/L.
点评:本题的亮点在于连续多个条件改变引起v-t图的变化,更有意思的是学生习惯于v正、v逆一起画,而本题只要求单画v逆,这打破了考生的思维定势,对于学生在真正考中顺利解答此类问题有着积极的作用.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
有关下列说法正确的是( )
| A、6.8g熔融KHSO4与3.9g Na202阴离子数目相同 |
B、某金属阳离子的结构为: 与Cl-形成的强电解质都是离子化合物 与Cl-形成的强电解质都是离子化合物 |
C、二硫化碳是直线型的分子,其电子式是: |
| D、因为氯、溴、碘非金属性逐渐减弱,所以其氢化物酸性HCl>HBr>HI |
下列物质均含有碳元素,其中属于氧化物的是( )
| A、C60 |
| B、CO |
| C、C2H2 |
| D、CH3OH |
 .如图所示是九种化合物的转变关系.
.如图所示是九种化合物的转变关系.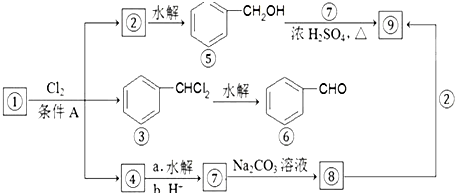
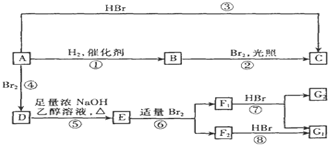 (D是
(D是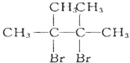 )
)
 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)