题目内容
 镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝的气体,该气体的化学式为
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A,其中浓硫酸的作用是
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08g.上述过程中,洗涤沉淀的操作是
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨.写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式
考点:性质实验方案的设计
专题:实验设计题
分析:(1)能使湿润的红色石蕊试纸变蓝色的气体是氨气;氮化镁和水反应生成氢氧化镁和氨气,据此分析方程式;
(2)浓硫酸具有酸性,能吸收碱性气体氨气,氨气易溶于水,加热抑制氨气溶解,根据N原子守恒计算氮化镁质量;
(3)浓硫酸具有吸水性,能吸收水蒸气而导致测定结果偏高;
部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;
洗涤操作方法为:向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作;
根据Mg原子守恒计算氮化镁质量,再根据质量分数公式计算氮化镁质量分数;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,据此书写反应方程式.
(2)浓硫酸具有酸性,能吸收碱性气体氨气,氨气易溶于水,加热抑制氨气溶解,根据N原子守恒计算氮化镁质量;
(3)浓硫酸具有吸水性,能吸收水蒸气而导致测定结果偏高;
部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;
洗涤操作方法为:向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作;
根据Mg原子守恒计算氮化镁质量,再根据质量分数公式计算氮化镁质量分数;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,据此书写反应方程式.
解答:
解:(1)能使湿润的红色石蕊试纸变蓝色的气体是NH3;氮化镁和水反应生成氢氧化镁和氨气,反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:NH3; Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(2)氨气属于碱性气体,浓硫酸具有酸性,所以可以用浓硫酸吸收NH3,则浓硫酸的作用是吸收氨气;
氨气极易溶于水,升高温度抑制氨气溶解,所以加热能将装置A中反应生成的氨气全部驱赶到装置C中,从而减少实验误差;
C装置吸收的是氨气,根据N原子守恒得Mg3N2----2NH3,设氮化镁的质量为x,
Mg3N2----2NH3,
100 34
x ag
100:34=x:ag
x=
=
g,
故答案为:吸收生成的NH3;将装置A中反应产生的NH3全部驱赶到装置C中;
;
(3)浓硫酸具有吸水性,能吸收水蒸气而导致测定结果偏高,加热A能导致氨气中含有水蒸气,空气中含有水蒸气,所以NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;
部分NH3滞留在装置内导致没有完全被浓硫酸吸收,从而造成结果偏低;
洗涤操作方法为:向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2-3次;
燃烧后的固体中含MgO和Mg3N2两种物质,Mg3N2与水反应生成Mg(OH)2,经灼烧,固体最终全部变成MgO,
设氮化镁的质量为m,
Mg3N2→3MgO△m(固体增重)
100g 20g
m 0.08g
100g:20g=m:0.08g,
m(Mg3N2)=
=0.4g
故镁在空气中燃烧后生成的固体中Mg3N2的质量分数为
×100%=10%,
故答案为:C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次;10%;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,所以该反应方程式为:(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O,故答案为:(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O.
故答案为:NH3; Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(2)氨气属于碱性气体,浓硫酸具有酸性,所以可以用浓硫酸吸收NH3,则浓硫酸的作用是吸收氨气;
氨气极易溶于水,升高温度抑制氨气溶解,所以加热能将装置A中反应生成的氨气全部驱赶到装置C中,从而减少实验误差;
C装置吸收的是氨气,根据N原子守恒得Mg3N2----2NH3,设氮化镁的质量为x,
Mg3N2----2NH3,
100 34
x ag
100:34=x:ag
x=
| 100×ag |
| 34 |
| 50a |
| 17 |
故答案为:吸收生成的NH3;将装置A中反应产生的NH3全部驱赶到装置C中;
| 50a |
| 17 |
(3)浓硫酸具有吸水性,能吸收水蒸气而导致测定结果偏高,加热A能导致氨气中含有水蒸气,空气中含有水蒸气,所以NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;
部分NH3滞留在装置内导致没有完全被浓硫酸吸收,从而造成结果偏低;
洗涤操作方法为:向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2-3次;
燃烧后的固体中含MgO和Mg3N2两种物质,Mg3N2与水反应生成Mg(OH)2,经灼烧,固体最终全部变成MgO,
设氮化镁的质量为m,
Mg3N2→3MgO△m(固体增重)
100g 20g
m 0.08g
100g:20g=m:0.08g,
m(Mg3N2)=
| 100g×0.08g |
| 20g |
故镁在空气中燃烧后生成的固体中Mg3N2的质量分数为
| 0.4g |
| 4.0g |
故答案为:C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高;可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次;10%;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,所以该反应方程式为:(NH4)2SO4+MgO
| ||
| ||
点评:本题考查性质实验方案设计,明确物质的性质及实验原理是解本题关键,难点是误差分析,要根据物质性质结合实验装置分析误差,同时考查学生分析问题的缜密性,题目难度中等.

练习册系列答案
相关题目
一定条件下,将NO2与SO2以2:3的体积比置于密闭容器中发生上反应:NO2(g)+SO2(g)?SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1:4,则平衡时SO2(g)的转化率是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
| 物质 | X | T | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600(mol/L)-2 |
| C、改变温度可以改变此反应的平衡常数 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
将镁粉和碳酸镁的混和物置于氧气中灼烧,直至质量不再改变为止,经测定,灼烧后所得的固体质量与原混和物的质量相同,则原混和物中镁粉和碳酸镁的质量比为( )
| A、4:7 | B、10:7 |
| C、14:11 | D、11:14 |
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: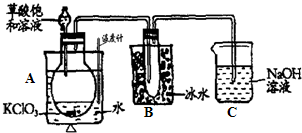
 某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表: 实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题:
实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题: