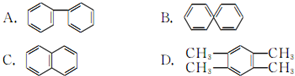题目内容
6.下列叙述正确的是( )①固体氯化钠不能导电,但氯化钠是电解质
②金刚石不能导电,所以金刚石是非电解质
③通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
④溶液中溶质分子或离子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
⑤氨水能导电,所以氨气是电解质
⑥有机化合物都是非电解质
⑦不是电解质(非电解质)的物质一定是非电解质(电解质)
⑧MgCl2、H2SO4、NaOH都是电解质,它们在水溶液和熔融状态下都能导电
⑨Na2CO3和NaHCO3的电离方程式分别是Na2CO3═2Na++CO32-,NaHCO3═Na++H++CO32-
⑩CaCO3、BaSO4均难溶于水,它们属于非电解质.
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
分析 ①固体氯化钠不能导电,但氯化钠溶于水后自身能够发生电离,是电解质;
②金刚石不是化合物,既不是电解质也不是非电解质;
③通电时溶质电离出的阴阳离子分别移向两极,溶质是非电解质时不移向任何电极;
④溶液中溶质粒子的运动无规律,胶体中分散质粒子的运动无规律,即布朗运动;
⑤氨水能导电,但氨气自身不能发生电离,是非电解质;
⑥某些有机化合物是电解质,如乙酸等;
⑦不是电解质(非电解质)的化合物一定是非电解质(电解质);
⑧H2SO4是共价化合物,在熔融状态下不能导电;
⑨NaHCO3的电离方程式分别是NaHCO3═Na++HCO3-;
⑩CaCO3、BaSO4均难溶于水,它们属于电解质.
解答 解:①固体氯化钠中离子不能自由移动,不能导电,但氯化钠溶于水后自身能够发生电离,是电解质,故①正确;
②金刚石不是化合物,既不是电解质也不是非电解质,故②错误;
③通电时,溶液中的溶质粒子是电解质,电离出的阴阳离子分别向两极移动,若溶质是非电解质不移向电极,胶体中的分散质粒子向某一极移动,故③错误;
④溶液中溶质粒子的运动无规律,胶体中分散质粒子的运动无规律,即布朗运动,故④错误;
⑤氨水能导电,但氨气自身不能发生电离,是非电解质,故⑤错误;
⑥某些有机化合物是电解质,如乙酸等,故⑥错误;
⑦不是电解质(非电解质)的化合物一定是非电解质(电解质),故⑦错误;
⑧MgCl2、H2SO4、NaOH都是电解质,H2SO4是共价化合物,在熔融状态下不能导电,MgCl2、NaOH是离子化合物,在水溶液和熔融状态下都能导电,故⑧错误;
⑨NaHCO3的电离方程式分别是NaHCO3═Na++HCO3-,故⑨错误;
⑩CaCO3、BaSO4均难溶于水,它们属于电解质,故⑩错误;
故选A.
点评 本题考查较为综合,涉及学生电解质、非电解质的概念、物质导电的原因、分散系的性质等,都是基础知识的考查,题目较简单.

 阅读快车系列答案
阅读快车系列答案CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
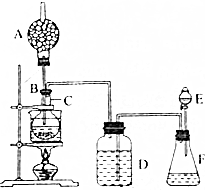
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状 态 | 无 色 液 体 | 无 色 液 体 | 无 色 液 体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
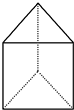
| A. | Na+ | B. |  | C. |  | D. |  |
①Al2O3 ②(NH4)2CO3 ③甘氨酸 (
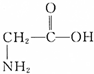 ) ④
) ④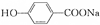 ⑤葡萄糖 ⑥乙酰水杨酸钠.
⑤葡萄糖 ⑥乙酰水杨酸钠.| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①⑤⑥ |
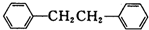 )是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:(一)催化剂的制备
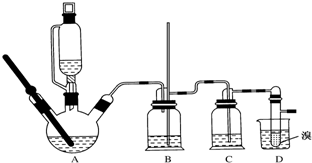
如图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品
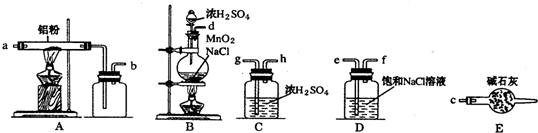
(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,f接g,h接a,b接c.
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3,你认为是否可行不可行 (填“可行”或“不可行”),你的理由是制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸.
(3)装置A中隐藏着一种安令隐患,请提出一种改进方案:在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞.
(二)联苯的制备
联苯的制取原理为:
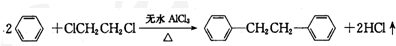
反应最佳条件为n(苯):n(1,2-二氯乙烷)=10:1,反应温度在60-65℃之间.实验室制取联苯的装置如图所示(加热和加持仪器略去)
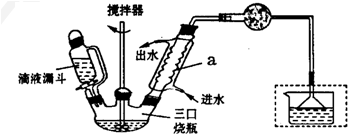
实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.7 mL 1,2-二氯乙烷,控制反应速度在60-65℃,反应约60 min.将反应后的化合物依次用稀盐酸、2% Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过滤,先常压蒸馏,在减压蒸馏收集170〜172℃的馏分,得联苯18.2 g.
相关物理常数和物理性质如表
| 名称 | 相对分子质量 | 密度/(g•cm-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
(5)洗涤操作中,水洗的目的是洗掉Na2CO3(或洗掉可溶性无机物),无水硫酸镁的作用是吸水剂(干燥剂).
(6)常压蒸馏时,最低控制温度是83.5℃.
(7)该实验的产率约为72.85% (小数点后保留两位有效数字).
| A. | 无机盐 | B. | 油脂 | C. | 水 | D. | 蛋白质 |
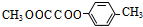 .
.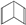 (Ⅰ)和
(Ⅰ)和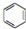 (Ⅱ)
(Ⅱ)